已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,向Mg(OH)2的澄清饱和溶液中加入少量的NH4Cl固体,c(Mg2+)升高 |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的溶解度小于在20 mL 0.01mol/LNH4Cl溶液中的溶解度 |
| D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
某学生设计了如图的方法对A盐进行鉴定: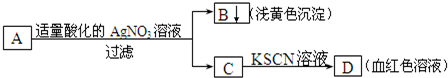
由此分析,下列结论中,正确的是
| A.A中一定有Fe2+ | B.B为AgI沉淀 |
| C.A中可能有Fe3+ | D.A一定为FeBr2溶液 |
下列示意图与对应的反应情况正确的是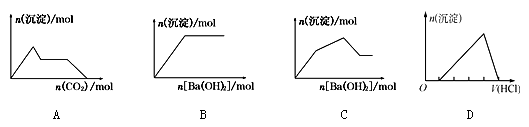
| A.含0.01 mol NaOH和0.01 mol Ba(OH)2的混合溶液中缓慢通入CO2 |
| B.KHCO3溶液中逐滴加入Ba(OH)2溶液 |
| C.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 |
| D.向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸 |
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是
| A.a点对应的溶液中:Na+、AlO2-、SO42-、NO3- |
| B.b点对应的溶液中:Ba2+、K+、NO3-、Cl- |
| C.c点对应的溶液中:Na+、Ag+、Mg2+、NO3- |
| D.d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
某稀溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入适量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法正确的是
| A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
| B.若向该溶液中加入过量的稀硫酸,溶液颜色会变成浅绿色 |
| C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液不显血红色 |
| D.若向该溶液中加入过量的稀硫酸,产生的气体在标况下的体积约为7.467 L |
已知硫酸亚铁溶液中加入过氧化钠时发生反应:
4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是
| A.该反应中Na2O2既是氧化剂又是还原剂,O2是还原产物 |
| B.若Fe2+失去4mol电子,生成氧气的体积约为22.4L |
| C.4 mol Na2O2在反应中共得到6NA个电子 |
| D.反应过程中可以看到白色沉淀先转化为灰绿色后转化为红褐色 |