如图所示,通电一段时间后,Cu电极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为100 mL,则通电前A池中原混合溶液Cu2+的浓度为( )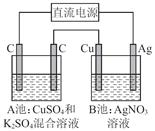
| A.0.05 mol/L | B.0.035 mol/L |
| C.0.025 mol/L | D.0.020 mol/L |
已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。
下列判断正确的是
| A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2 |
| B.上述实验中,共有两个氧化还原反应 |
| C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| D.实验②证明Fe2+既有氧化性又有还原性 |
酸根离子RO3-所含电子数比硝酸根离子NO3-的电子数多10,则下列说法正确是
①R原子的电子层数比N原子的电子层数多1
②RO3-中R元素与NO3-中N元素的化合价相同
③RO3-和NO3-只能被还原,不可能被氧化
④R和N不是同周期元素,但是同主族元素
| A.①③④ | B.①②④ | C.①② | D.③④ |
X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于
Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是
A WX4是沼气的主要成分 B固态X2Y是分子晶体
C ZW是原子晶体 D ZY2的水溶液俗称“水玻璃”
能用键能大小解释的是
A N2的化学性质比O2稳定得多 B常温常压下,溴呈液态,碘呈固态
C 稀有气体一般很难发生化学反应 D硝酸易挥发而磷酸难挥发
下列离子方程式中,正确的是
A.向氯化亚铁溶液中通入氯气 Fe2++Cl2Fe3++2Cl-
B.三氯化铁溶液跟过量氨水反应Fe3++3NH3·H2OFe(OH)3↓+3NH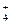
C碳酸氢钙溶液跟稀硝酸反应Ca(HCO3)2+2H+Ca2++2H2O+2CO2↑
D氯气通入冷的氢氧化钠溶液中2Cl2+2OH-3Cl-+ClO-+H2O