下列有关实验操作或方法正确的是( )
| A.NaCl溶液蒸发结晶时,蒸发皿中刚好有晶体析出时即停止加热 |
| B.烧碱属于离子化合物,熔点较高,实验室中可选用石英坩埚熔化烧碱 |
| C.滴定时,左手控制滴定管活塞,右手摇动锥形瓶,眼睛注视滴定管中液面的变化 |
| D.用CCl4从碘水中萃取碘,有一步操作为“将分液漏斗倒转过来振荡,使两种液体充分接触” |
下列有关工业生产的叙述正确的是()
| A.合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
| C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
| D.侯氏制碱法是将氨气和二氧化碳先后通入饱和氯化钠溶液中,制得碳酸氢钠固体,再在高温下灼烧,转化为碳酸钠固体 |
下列工业生产所涉及的化学用语表达不正确是()
A.工业上制取氯气:MnO2+4HCl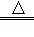 Cl2↑+MnCl2+H2O Cl2↑+MnCl2+H2O |
B.工业上合成氨:N2+3H2  2NH3 2NH3 |
C.工业上制取粗硅:SiO2+2C Si+2CO↑ Si+2CO↑ |
| D.工业上生产漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
传统合成氨工业需要采用高温、高压和催化剂.近来美国化学家使用新型铁系催化剂,在常温下合成了氨气.下列说法正确的是()
| A.新型合成氨方法是吸热反应 |
| B.新型合成氨方法可简化生产设备 |
| C.新型催化剂提高了N2和H2的转化率 |
| D.两种方法中该反应的化学平衡常数相同 |
符合目前工业生产实际的化工生产原理是()
| A.合成氨工业中,由于氨易液化,N2、H2循环使用,所以总体上氨的产率很高 |
| B.氯气和氢气混合在光照条件下反应生成氯化氢,用水吸收得到盐酸 |
| C.氯碱工业中,电解槽的阳极区产生NaOH |
| D.二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸 |
化学在生产和日常生活中有着重要的应用.下列说法不正确的是()
| A.K2FeO4能与水缓慢反应生成Fe(OH)3和O2,故可用作水的消毒剂和净化剂 |
| B.钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 |
| C.常温下氨能与氯气反应生成氯化氢和氮气,因此可用浓氨水检查氯气管道某处泄漏 |
| D.用氯气与乙烷混合光照获得纯净的1,2﹣二氯乙烷 |