氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g)NH2COONH4(s) ΔH<0。
(1)如图所示装置制取氨气,你所选择的试剂是________________________。
(2)制备氨基甲酸铵的装置如图13-7所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。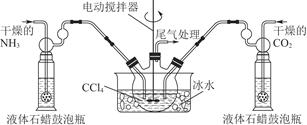
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是________________________________________________________________________________________________________________________________________________。
液体石蜡鼓泡瓶的作用是________________________________________________________________________。
②从反应后的混合物中分离出产品的实验方法是________________________________________________________________________
(填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40 ℃以下烘干
③尾气处理装置如图所示。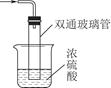
双通玻璃管的作用:____________;浓硫酸的作用:______________________、__________________________________________________________________。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173 0 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500 g。则样品中氨基甲酸铵的物质的量分数为________。[Mr(NH2COONH4)=78,Mr(NH4HCO3)=79,Mr(CaCO3)=100]
(9分)有下列化学仪器:①托盘天平;②玻璃棒;③药匙;④烧杯;⑤量筒;⑥容量瓶;⑦胶头滴管;⑧细口试剂瓶;⑨标签纸。
(1) 现需要配制500 mL 1 mol/L硫酸溶液,需用质量 分数为98%、密度为1.84g/㎝3的浓硫酸______ mL。(小数点后保留1位有效数字)
分数为98%、密度为1.84g/㎝3的浓硫酸______ mL。(小数点后保留1位有效数字)
(2) 从上述仪器中,按实验使用的先后顺序,其编号排列是________
(3) 容量瓶使用前检验漏水的方法是____________
(4)若实验遇到下列情况,对所配制硫酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①用以稀释硫酸的烧杯未洗涤__________
②未经冷却趋热将溶液注入容量瓶中___________
③摇匀后发现液面低于刻度线再加水_____________
④容量瓶中原有少量蒸馏水_____________
⑤定容时俯视观察液面__________________
为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。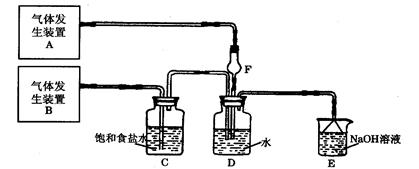
(1)气体发生装置A产生的气体是 ;
;
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
① 氯化铁溶液 ② 氯化亚铁溶液 ③ 硫氰化钾溶液
④ 苯酚溶液 ⑤ 品红溶液 ⑥ 酸性高锰酸钾溶液
I :若Cl2过量:取适量D中溶液滴加至盛有(选填一个序号)试剂的试管内,再加入(选填一个序号)试剂,实验现象是:;
II : 若SO2过量:取适量D中溶液滴加至盛有(选填一个序号)试剂的试管内,实验现象是:;
(3)另一小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。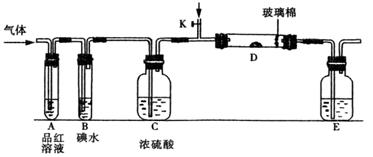
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?(填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0mol/L碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,该反应的化学方程式为 。
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 .
(8分)为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:
加过量A后过滤加过量B后过滤
(1)3种试剂的化学式:A________,B________,C________。
(2)加过量A的原因是___________________________________, 有关反应的化学方程式为________________________________。
有关反应的化学方程式为________________________________。
(3)加过量B的有关反应的化学方程式为
_________________________________ _________________________________。
_________________________________。
中和热的测定是高中重要的定量实验。取0.55 的NaOH溶液50mL与0.50
的NaOH溶液50mL与0.50 的盐酸50mL置于右图所示的装置中进行中和热的测定实验,回答下列问题:
的盐酸50mL置于右图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从右图实验装置看,其中尚缺少的一种玻璃用品是____________,除此之外,装置中的一个明显错误是。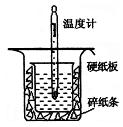
(2)右图中的小烧杯应该选择下列哪种规格的。(选填代号)
①50 mL ②100 mL ③150 mL ④250 mL
(3)为了便于计算,假定混合前后溶液的密度都近似为1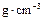 ,假定反应后生成溶液的比热容近似为水的比热容
,假定反应后生成溶液的比热容近似为水的比热容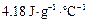 ,用t1℃和t2℃代表反应前后溶液的温度,则该实验中和热的计算表达式为
,用t1℃和t2℃代表反应前后溶液的温度,则该实验中和热的计算表达式为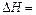 。
。
某校化学学习小组拟验证NO能被氨气还原并测定其转化率,设计如下实验:
参考知识:NO气体与FeSO4溶液反应生成可溶性硫酸亚硝基合铁(Ⅱ):NO+FeSO4=Fe(NO)SO4
试回答下列问题:
⑴实验室用氯化铵与氢氧化钙固体制备氨气,应选用的装置是
该反应的化学方程式
实验室通常用法收集氨气,检验该气体是否收集满方法
⑵装置③、④若用同一装置,则该装置中所盛装的药品是
| A.Na2O2 | B.浓硫酸 | C.P2O5 | D.碱石灰 |
⑶装置⑥中,粗玻璃管X的作用,装置⑦的作用
⑷装置⑥的广口瓶中,除生成Fe(NO)SO4外,还有白色沉淀生成,写出生成该沉淀的离子方程式
⑸若参加反应的NO为2.688L(标准状况,下同),氨气过量,最后收集到2.016LN2,则装置⑤中NO的转化率为