乙二酸俗称草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x的值。通过查阅资料该小组同学知道,草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应式为:2MnO4-+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O
该组同学设计了如下滴定方法测定x的值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到反应终点时消耗了10.00mL;
请回答:
(1)滴定时,将KMnO4标准溶液装在图中的 (选填“甲”或“乙”)滴定管中。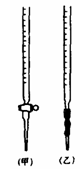
(2)本实验滴定达到终点的标志是 。
(3)通过上述数据,可计算出x= 。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会 (选填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。(同上)
(14分)某化学兴趣小组为了探究AgNO3的性质,通过查阅资料和老师指导设计了如下实验:
Ⅰ.探究AgNO3的氧化性
实验方法:将光亮的铁丝伸入新配制的AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,先将溶液中的Ag除尽后,进行了如下实验。可选用的试剂:蒸馏水、稀氨水、KSCN溶液、高锰酸钾酸性溶液、新制氯水。
(1)请完成下表:
| 实验操作 |
现象 |
结论 |
| 取少量除尽Ag+后的溶液于试管中,____________________,充分振荡 |
_____________________ _____________________ |
存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,____________________,充分振荡 |
_____________________ _____________________ |
不存在Fe2+ |
【实验结论】Fe的氧化产物为Fe3+。
Ⅱ.探究AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。
当反应结束后,试管中残留同体为黑色。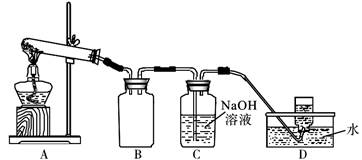
(2)装置B的作用是________________________。
(3)经小组讨论并验证该无色气体为O2,其验证方法是___________________________________。
(4)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水和稀硝酸。
【提出设想】试管中残留的黑色同体可能是:i.Ag;ii.Ag2O;iii.__________________。
【实验验证】该小组为验证上述设想iii是否成立,进行了如下实验(仪器和药品任选)
| 实验操作 |
现象和结论 |
【实验结论】若假设i成立,该小组得出AgNO3固体热分解反应的化学方程式为______________。
(15分)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,常用于水的消毒杀菌和织物的漂白。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下: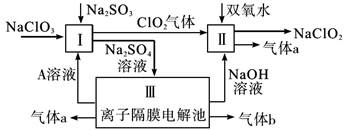
(1)反应I中的Na2SO3长期存放通常含有Na2SO4杂质,可用滴定法测定Na2SO3的纯度,向Na2SO3溶液中滴加酸性KMnO4溶液,酸性KMnO4溶液应使用_________滴定管,滴定前,若该滴定管尖嘴处有气泡存在,赶除气泡的操作方法为____________________。
(2)Ⅱ中反应的离子方程式是_____________________________________________。
(3)A的化学式是________________,装置Ⅲ中b在极区产生______________________。
(4)已知ClO2对污水中CN-等有明显的去除效果,某工厂污水中含CN-amg/L,现用ClO2将CN-氧化生成两种无毒的气体,自身被还原为Cl-;该反应离子方程式为_____________;处理100m3这种污水,至少需要ClO2的质量为_______g(保留到小数点后一位)。
(5)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 |
HClO2 |
HF |
HCN |
H2S |
| Ka |
1×10-2 |
6.3×10-4 |
4.9×10-10 |
K1=9.1×10-8 K2=1.1×10-12 |
常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为__________;体积相等、物质的量浓度相同的NaClO2、NaCN两溶液中所含阴阳离子总数的大小关系为________(填“前者大”、“相等”或“后者大”)。
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。
(1)某研究小组拟用下图装置测定一定质量的样品中过氧化镁的含量。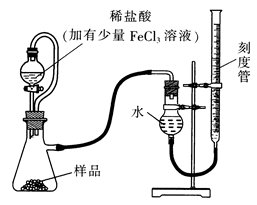
①实验前需进行的操作是.稀盐酸中加入少量FeCl3溶液的作用是。
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下;。
③实验终了时,待恢复至室温,先,再平视刻度线读数。
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
方案Ⅱ:称取0.1 g样品置于碘量瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗VmL Na2S2O3溶液。(已知:I2+2Na2S2O3= Na2S4O6+2NaI)
①已知常温下Ksp[Mg(OH)2]=l×10-11。为使方案I中Mg2+完全沉淀[即溶液中c(Mg2+)≤l ×10-5mol/L],溶液的pH至少应调至。方案I中过氧化镁的质量分数为(用含a、b的表达式表示)。
②方案Ⅱ中滴定前需加入少量作指示剂;样品中过氧化镁的质量分数为(用含V的表达式表示)。
(15分)某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程脱除燃煤尾气中的SO2,同时制得电池材料MnO2(反应条件已省略)。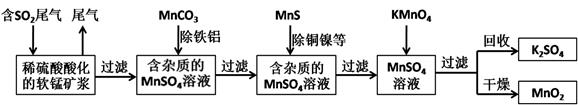
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、、;其中玻璃棒的作用是。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是。
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是mol/L。
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中惰性电极作阳极,铁作阴极,请写出阳极的电极反应式。
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是_________。(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过制得硫酸锰晶体。(MnSO4•H2O,相对分子质量为169)
a.过滤
b.蒸发浓缩
c.冷却结晶
d.灼烧
e.干燥
(7)已知废气中SO2浓度为8.4 g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000 m3燃煤尾气,可得到硫酸锰晶体质量为kg(结果保留3位有效数字)。
某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电解率。
饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%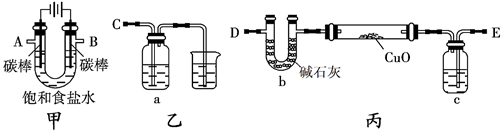
甲方案:利用甲、乙装置测定饱和食盐水的电解率。
(1)若饱和食盐水中滴有酚酞,则电解过程中甲装置中的实验现象:。
(2)若洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,则正确的连接顺序为连________(填A、B、C、D、E等导管口),则洗气瓶a中发生反应的离子方程式为。
乙方案:利用甲、丙装置测定饱和食盐水的电解率。
(3)对于乙方案,有同学提出有两种方法都可测得饱和食盐水的电解率。
Ⅰ.通过测定硬质玻璃管中氧化铜固体前后质量差来计算饱和食盐水的电解率
Ⅱ.通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率
①一同学认为可以在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,则该干燥装置应与口连接。
a.Ab.Bc.Dd.E
②另一同学认为乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,你是否同意?请说明理由。
丙方案:只利用甲装置测定饱和食盐水的电解率。
(4)若电解150mL饱和食盐水一段时间,测得溶液的为pH为14,求饱和食盐水的电解率
(假设电解前后溶液体积不变,饱和食盐水密度约为1.33 g/mL,溶解度为36.0g)。
若往该电解后所得溶液中通入二氧化碳气体2.24L(标准状况),则所得溶液中各离子浓度大小关系为:。