(14分)某化学兴趣小组为了探究AgNO3的性质,通过查阅资料和老师指导设计了如下实验:
Ⅰ.探究AgNO3的氧化性
实验方法:将光亮的铁丝伸入新配制的AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,先将溶液中的Ag除尽后,进行了如下实验。可选用的试剂:蒸馏水、稀氨水、KSCN溶液、高锰酸钾酸性溶液、新制氯水。
(1)请完成下表:
| 实验操作 |
现象 |
结论 |
| 取少量除尽Ag+后的溶液于试管中,____________________,充分振荡 |
_____________________ _____________________ |
存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,____________________,充分振荡 |
_____________________ _____________________ |
不存在Fe2+ |
【实验结论】Fe的氧化产物为Fe3+。
Ⅱ.探究AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。
当反应结束后,试管中残留同体为黑色。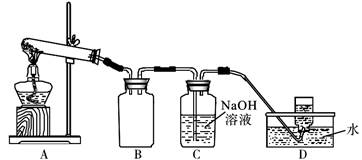
(2)装置B的作用是________________________。
(3)经小组讨论并验证该无色气体为O2,其验证方法是___________________________________。
(4)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水和稀硝酸。
【提出设想】试管中残留的黑色同体可能是:i.Ag;ii.Ag2O;iii.__________________。
【实验验证】该小组为验证上述设想iii是否成立,进行了如下实验(仪器和药品任选)
| 实验操作 |
现象和结论 |
| |
|
【实验结论】若假设i成立,该小组得出AgNO3固体热分解反应的化学方程式为______________。
长期存放的亚硫酸钠可能会被氧化,某化学课外活动小组现通过实验来确定某无水亚硫酸钠变质,并测定亚硫酸钠的纯度。
Ⅰ.有三位学生各取少量样品设计了下述三个实验方案,并都认为如果观察到的现象和自己设计的方案一致,即可确证试液中有SO42-离子。你认为合理的方案有。
方案甲:试液 白色沉淀
白色沉淀 白色沉淀。
白色沉淀。
方案乙:试液 有无色气体生成
有无色气体生成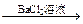 白色沉淀。
白色沉淀。
方案丙:试液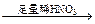 无色溶液
无色溶液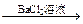 白色沉淀。
白色沉淀。
Ⅱ.同学丁取35g该样品,加入800mL某浓度的盐酸,加热使生成的气体全部逸出,所得气体用氨水吸收,溶液增重16g。然后向原溶液中逐滴加入0.5mol/L的Ba(OH)2溶液500mL。有沉淀生成,此时溶液呈中性。
(1)用氨水吸收气体发生反应的可能的离子方程式
。
(2)样品中Na2SO3的纯度是,盐酸的物质的量浓度________________。
某同学欲用右图装置制备乙酸乙酯,其中a试管中是浓硫酸、乙醇、乙酸的混合液, b试管盛饱和Na2CO3溶液。回答下列问题: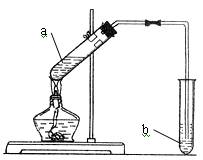
(1)指出装置中一个明显的错误
(2)配制浓硫酸、乙醇、乙酸的混合液的正确操作顺序是。
(3)写出试管a中所发生反应的化学方程式,其反应类型为。
(4)反应结束后振荡b试管的混合液,可观察到b试管中有细小气泡冒出,写出表示该反应的离子方程式。
(5)从b试管中分离出乙酸乙酯的分离方法是。
(6)浓硫酸在此反应中的作用是。
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题
⑴第1步:灼烧。操作是将足量海带放到灼烧成灰烬。
A.试管 B.瓷坩埚
⑵第2步:Iˉ溶液的获取。操作是将灰烬转到烧杯中,加适量蒸馏水,用充分搅拌,煮沸,。(填操作名称)
⑶第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用。(填代号)A.新制氯水 B.H2O2 C.KMnO4溶液
理由是。
⑷第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
实验室里可用甲醇等有关物质制备HCHO,关于甲醇和甲醛的沸点和水溶性见下表:
| 沸点(℃) |
水溶性 |
|
| 甲醇 |
65 ℃ |
与水混溶 |
| 甲醛 |
-21 ℃ |
与水混溶 |
某校化学兴趣小组的甲、乙两位同学,在研究性学习中,运用以上信息和已有知识分别设计了二套实验室制取HCHO装置,如图甲和乙。据此请你回答下列问题:
(1)若按甲装置进行实验,则通入A试管的X应是________;B中反应的化学方程式是__________________________________________________。
(2)若按乙装置进行实验,则B管中应装入________。
(3)当实验完成时,若在C中滴加适量银氨溶液,并用水浴将C加热,发生反应的化学方程式是_________________________________________________________。
(4)在反应过程中,甲、乙两种装置中都需直接加热的仪器是________(填A、B、C)
(5)实验开始时,先打开气球D的开关,直至实验结束。气球D的作用是______________________________________________________________________。
(6)从生成甲醛的产量来看,你认为两套装置中较好的是________(填“甲”或“乙”)
糖尿病是“富贵病”,请你设计实验检验病人尿液中的葡萄糖,并与正常人作对比,设计要求:(1)写出实验所用化学药品。
(2)写出实验现象并作出结论。