有A、B、C、D、E、F 6种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有3个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。
请回答下列问题:
(1)E元素原子基态时的电子排布式为________________________________________________________________________。
(2)F的氧化物FO3分子的空间构型为________。
(3)CA3极易溶于水,其原因主要是________________________________________________________________________。
与其最简单分子互为等电子体的阳离子为________。
(4)下列分子结构图中的“ ”表示相关元素的原子中除去最外层电子的剩余部分,“
”表示相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。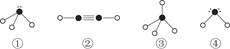
则在以上分子中,中心原子采用sp3杂化形成化学键的是________(填写序号);在②的分子中有________个σ键和________个π键。
(5)从图中可以看出,D与B形成的离子化合物的化学式为________。
(6)图中,若D与B的离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________________________________________________________________________(写出表达式即可)。
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。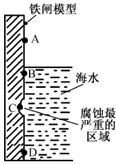
①该电化腐蚀称为。
②图中A和B区域相比较,腐蚀较慢的是(填字母)。
(2)实验室经常用到FeCl3溶液,在配制FeCl3溶液时常需加入少量的;将FeCl3溶液和碳酸氢钠溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为。
(3)已知t℃时,反应FeO(s)+CO(g) Fe( s) +CO2(g)的平衡常数K= 0.25。
Fe( s) +CO2(g)的平衡常数K= 0.25。
①t℃时,反应达到平衡时n(CO2):n(CO)=
②若在1L密闭容器中加人0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时
FeO(s)转化率为50%,则x=。
(1)将该温度下a mL pH="13" NaOH溶液与b mL0.05mol/L H2SO4混合,所得混合溶液的pH=7,
则a:b =
(2)若在含有足量AgCl固体的饱和AgCl溶液中分别放入:
| A.100mL蒸馏水中; | B.100mL 0.2 mol·L-1AgNO3溶液中; |
| C.100 mL 0.1 mol·L-1AlCl3溶液中; | D.100mL 0.1 mol·L-1盐酸溶液中。 |
充分搅拌后,银离子浓度最小的是(填序号)
(3)在25℃下,向浓度均为0.20 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为;当测得溶液pH=11.00时,则此温度下残留在溶液中的c(Mg2+):c(Cu2+)=
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.0×10-20)
(1)AgNO3的水溶液呈酸性的原因是(用离子方程式表示):;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解。
(2)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有,其浓度由大到小的顺序为,氨水的浓度a0.01 mol·L-1(填“>”、“<”或“=”)。
(3)用已知浓度的NaOH标准溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
| A.未用标准液润洗碱式滴定管; |
| B.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液; |
| C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗; |
| D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确; |
已知:N2O4(g)  2NO2(g) ΔH="+57.20kJ" · mol-1
2NO2(g) ΔH="+57.20kJ" · mol-1
在100℃时,将0.100molN2O4气体充入1L恒容抽空的密闭容器中,每隔一定时间对该容器内的物质浓度进行分析得到下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| c(N2O4) /mol··L-1 |
0.100 |
c1 |
0.050 |
c3 |
c4 |
| c(NO2) /mol·L-1 |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1) 该反应的平衡常数表达式为 ______;从表中数据分析:
c1c2 (填“>” 、“<” 或“="”" )。
(2)下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.NO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗n mol N2O4的同时生成2n mol NO2
E.反应体系中NO2、N2O4的体积比为1:2
(3)若起始时充入NO2气体0.200mol,则达到平衡时NO2气体的转化率为a;其它条件不变时,下列措施能提高NO2转化率的是(填字母)。
A.降低温度
B.减小NO2的浓度
C.升高温度
D.增加NO2的浓度
E.再充入一定量的He
科学家一直致力于“人工固氮” 的方法研究。目前合成氨的技术原理为氮气和氢气在高温高压催化剂条件下生成氨气,一定条件下,向一个1L的密闭容器中充入2molN2和6molH2,反应达平衡时生成NH3的浓度为1 mol·L-1,并放出Q kJ热量,该反应的热化学方程式可表示为 ____ __。