硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域。
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为________,B原子的杂化类型为________。
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。图(a)是磷化硼晶体的晶胞示意图,则磷化硼的化学式为________,该晶体的晶体类型是________。
(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连[如图(b)]。
①硼酸分子中B最外层有________个电子,1 mol H3BO3的晶体中有________mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+离子。则硼酸为________元酸,[B(OH)4]-含有的化学键类型为________。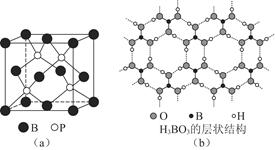
(1)某温度下,纯水中的c(H+)=2.0×10—7mol/L,此时溶液的c(OH—)= mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10—4mol/L,则溶液中,由水电离产生的c(H+)= mol/L,此时温度 25℃(填“高于”、“低于”或“等于”)。
(2)某温度下的水溶液中,c(H+) = 10x mol/L,c(OH—) = 10y mol/L,x和y的关系如图所示。计算: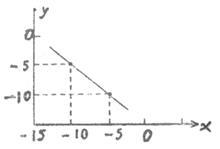
①该温度下水的离子积为_____
②该温度下,0.01mol/L的NaOH溶液的pH为_______
化学反应A(g)+B(g)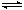 C(g)+D(g)ΔH<0,850℃时,K="l" t℃时,在一定体积的容器中,通入一定量的A和B,发生反应,各物质浓度随时间变化如下表:
C(g)+D(g)ΔH<0,850℃时,K="l" t℃时,在一定体积的容器中,通入一定量的A和B,发生反应,各物质浓度随时间变化如下表:
t℃时物质的浓度(mol·L-1)变化
| 时间/min |
A |
B |
C |
D |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100[科网] |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
(1)计算t℃该化学反应的平衡常数: 。
(2)t℃ 850℃(填大于、小于或等于)。判断依据是 。
(3)反应在4min~5min之间,平衡 (填“向左”、“向右”或“不”)移动,可能的原因是 。
a.增加A的浓度 b.增加D的浓度 c.增加C的浓度 d.使用催化剂
(4)某温度下反应C(g)+D(g) 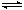 A(g)+B(g)的平衡浓度符合c(C)·c(D)=2c(A)·c(B),则此时的温度 850℃(填大于、小于或等于):
A(g)+B(g)的平衡浓度符合c(C)·c(D)=2c(A)·c(B),则此时的温度 850℃(填大于、小于或等于):
在0.24 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。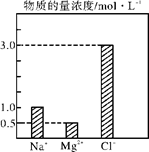
(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1200mL,稀释后溶液中Ca2+的物质的量浓度为______mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
化学是一门以实验为基础的自然科学,右图为某试剂瓶上的标签,试回答下列问题。
(1)该盐酸中HCl的物质的量浓度为________mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中随所取体积的多少而变化的是________。
| A.溶液中HCl的物质的量 |
| B.溶液的浓度 |
| C.溶液中Cl-的数目 |
| D.溶液的密度 |
(3)某学生欲用上述较浓盐酸和蒸馏水配制500 mL物质的量浓度为0.150 mol·L-1的稀盐酸。
①该学生需要量取________mL上述较浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏小”,填B表示“偏大”,填C表示“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面( )。
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水( )。
c.配溶液用的容量瓶用蒸馏水洗涤后未经干燥( )。
化学实验是学习化学的基础,要通过实验去学习化学。
(1)下列关于实验的叙述中正确的有________。
| A.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抺布灭火 |
| B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 |
| C.用托盘天平称量物品质量时,物品应置于右盘 |
| D.实验时应节约药品,实验剩余的药品应放回原试剂瓶 |
E.可燃性气体点燃前一定要验纯
F.使用分液漏斗前必须检查其是否漏水
(2)请将下列错误实验操作可能会引起的不良后果填在表格中。
| 实验 |
向试管中加锌粒 |
对量筒中液体读数 |
浓硫酸的稀释 |
| 错误操作 |
 |
 |
 |
| 不良后果 |