常温下,有关下列4种溶液的说法正确的是
| ① |
② |
③ |
④ |
| 0.1 mol·L-1氨水 |
pH=11氨水 |
0.1 mol·L-1盐酸 |
pH=3盐酸 |
A.由水电离出的c(H+):③>①
B.①稀释到原来的100倍,pH与②相同
C.①与③混合,若溶液pH=7,则溶液中c(NH4+)>c(Cl-)
D.②与④等体积混合,混合液pH>7
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法正确的是
| A.X的氢化物溶于水显酸性 | B.X与Y形成化合物的化学式为X2Y2 |
| C.Y的氧化物是离子化合物 | D.X和Z的最高价氧化物对应水化物都是弱酸 |
已知RO32-的R原子核内有x个中子,R的质量数为A,则m g RO32-含有电子的物质的量为
A. mol mol |
B.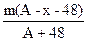 mol mol |
C. mol mol |
D. mol mol |
下列分子中所有原子都满足最外层8电子结构的是
① CO2,② CH4,③ PCl3,④ PCl5,⑤ BeCl2,⑥ N2[
| A.①④⑤ | B.①③⑥ | C.②④ | D.②③④⑤ |
科学家最近发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子 ”,也有人称之为“零号元素”;第二种是由四个氮原子构成的分子。下列有关
”,也有人称之为“零号元素”;第二种是由四个氮原子构成的分子。下列有关 这两种粒子的说法不正确的是
这两种粒子的说法不正确的是
| A.“四中子” 粒子不显电性 | B.被称为零号元素是因为该粒子不含质子 |
| C.相同质量的N2和N4所含原子个数比为1∶2 | |
| D.第二种粒子的化学式为N4,与N2互为同素异形体 |
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法中,不正确的是
| A.1mol NH5中含有5 NA个N-H 键(NA表示阿伏伽德罗常数) |
| B.NH5中既有离子键又有共价键 |
| C.NH5的熔沸点高于NH3 |
| D.NH5固体投入水中的反应方程式是:NH4H+H2O=NH3·H2O+H2↑ |