下列叙述正确的是( )
| A.常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
| B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH<0 |
| C.常温下,将pH =10的氨水稀释,溶液中所有离子浓度都减小 |
| D.常温下,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
在下列各组溶液中,离子一定能大量共存的是
| A.加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I- |
B.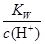 =0.1 mol·L-1的溶液:Na+、K+、SiO32-、NO3- =0.1 mol·L-1的溶液:Na+、K+、SiO32-、NO3- |
| C.FeCl3溶液:K+、Na+、SO42-、AlO2- |
| D.含0.1mol/LNH4Al(SO4)2的溶液:K+、Ca2+、HCO3-、Cl- |
已知非金属单质在碱性条件下易发生岐化反应,而其生成物在酸性条件下能够发生归中反应。现将aKOH、bH2O、cKCl、dKClO、eCl2、fKClO3可组成一个氧化还原反应,则下列有关说法错误的是
| A.c、d、f之比可能为16:1:3 |
| B.一定有a=2e,b=e |
| C.若n(KClO):n(KClO3)==1:1,则a、b、c、d、e、f依次为8,4,6,1,4,1 |
| D.若将该方程式拆开写成两个“半反应”,其中一定有Cl2-2e- = 2Cl- |
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
| A.Na+ | B.SO42- | C.Ba2+ | D.NH4+ |
向含2mol NaOH、1mol Ba(OH)2、2mol NaAlO2的混合液中慢慢通入CO2至过量,下列有关说法正确的是
| A.整个过程中共发生四个离子反应。 |
| B.根据现象可判断酸性强弱为:H2CO3>HAlO2>HCO3- |
| C.通入3molCO2和通入5molCO2都只产生3mol沉淀 |
| D.整个过程中生成沉淀的物质的量与通入CO2的体积的图象如图所示: |

下列有关物质的分类正确的是
| 酸性氧化物 |
一元酸 |
强电解质 |
分散系 |
|
| A |
Mn2O7 |
丙酸 |
三氧化二铝 |
黄河水 |
| B |
NO2 |
高氯酸 |
盐酸 |
有色玻璃 |
| C |
SiO2 |
石炭酸 |
氢氧化铝 |
云、雾 |
| D |
SO2 |
硝酸 |
溴化氢 |
冰水混合物 |