下列叙述不正确的是( )
| A.化学平衡发生移动,平衡常数不一定发生变化 |
| B.升高温度会增大化学反应速率,其原因是增大了活化分子的百分数 |
C.某化学反应的能量变化如图所示,则该反应的ΔH>0,ΔS>0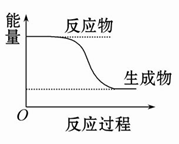 |
D.H3PO4的电离常数:  |
下列说法正确的是
| A.呈酸性的雨水就是酸雨 | B.“雷雨肥庄稼”符合科学道理 |
| C.雾和雾霾都属于气溶胶 | D.白色物质引起的污染叫白色污染 |
相同质量的铝分别与足量的稀盐酸和氢氧化钠溶液反应,下列说法不正确的是
| A.相同条件下,产生气体的体积相等 |
| B.生成的铝的化合物的物质的量相等 |
| C.消耗酸和碱的物质的量相等 |
| D.相同条件下,转移的电子数相等 |
下列所给粒子间的数量满足2:1关系的是
| A.氧化钠中的氧离子和钠离子 |
| B.二氧化硅中的硅原子和氧原子 |
| C.过氧化钠中的钠离子和过氧根离子 |
| D.碳酸溶液中的氢离子和碳酸根离子 |
必须通过加入其它试剂才能鉴别的一组无色溶液是
| A.氯化铝溶液和氢氧化钾溶液 | B.碳酸氢钠和稀盐酸 |
| C.偏铝酸钠溶液和稀硝酸 | D.碳酸钠和稀硫酸 |
对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
| A.达到化学平衡时,υ正=υ逆=0 |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 |
| C.达到化学平衡时,若增大容器体积,则正反应速率减少,逆反应速率增大 |
| D.达到化学反应平衡后,改变条件当υ正>υ逆,平衡向正反应方向移动 |