某同学想用实验证明高锰酸钾的紫红色是MnO4-的颜色,而不是K+的颜色,他设计了以下实验方案。请你判断下列方案与本实验目的无关的是( )
| A.观察氯化钾溶液没有颜色,表明溶液中的K+无色 |
| B.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+不反应 |
| C.在高锰酸钾溶液中加入适量锌粉、振荡、静置后紫红色褪去,表明MnO4-为紫红色 |
| D.将高锰酸钾晶体加热分解,所得的固体质量减轻 |
仔细分析下列表格中烃的排列规律,判断排列在第15位烃的分子式是
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
…… |
| C2H2 |
C2H4 |
C2H6 |
C3H4 |
C3H6 |
C3H8 |
C4H6 |
C4H8 |
C4H10 |
…… |
A.C6H12 B.C6H14 C.C7H12 D.C7H14
分析下图所示装置,下列叙述不正确的是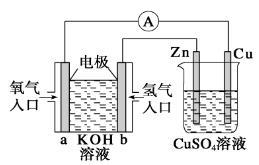
| A.左边装置是燃料电池,右边装置是电镀池 |
| B.电子流动方向:b→Zn→CuSO4(aq)→Cu→a |
| C.一段时间后,左端溶液浓度变小,右端溶液浓度不变 |
| D.当锌片的质量变化12.8g时,a极消耗标准状况下的O2 2.24 L |
将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽中,置于光亮处(如图所示),下列有关此实验的现象和结论的叙述不正确的是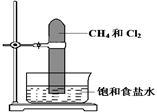
| A.试管中气体的黄绿色逐渐变浅,水面上升 |
| B.生成物只有三氯甲烷和氯化氢在标准状况下是气体 |
| C.试管内壁有油状液滴形成 |
| D.试管内有少量白雾 |
下列关于甲烷、乙烯、苯三种烃的比较中,正确的是
| A.只有甲烷不能因化学反应而使酸性高锰酸钾溶液褪色 |
| B.在空气中分别完全燃烧等物质的量的这三种烃,甲烷消耗的氧气最多 |
| C.除甲烷外,其余两种分子内所有原子都共平面 |
| D.甲烷和苯属于饱和烃,乙烯是不饱和烃 |
对于苯乙烯的下列叙述中,正确的是
①能使酸性KMnO4溶液褪色
②可发生加成反应
③可溶于水
④可溶于苯中
⑤能与浓硝酸在浓H2SO4作用下发生取代反应
⑥所有的原子可能共平面。
| A.①②③④⑤ | B.①②⑤⑥ |
| C.①②④⑤⑥ | D.全部 |