铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列三种不同实验方案进行探究。填写下列空白。
【探究一】实验方案:铝镁合金 测定剩余固体质量,实验中发生反应的化学方程式是_________________________。
测定剩余固体质量,实验中发生反应的化学方程式是_________________________。
实验步骤:
(1)称取5.4 g铝镁合金粉末样品,投入V mL 2.0 mol·L-1 NaOH溶液中,充分反应。NaOH溶液的体积V≥______。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏高”或“偏低”)。
【探究二】实验方案:铝镁合金 测定生成气体的体积实验装置:
测定生成气体的体积实验装置:
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是:_____(填“需要”或“不需要”)。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①______________________________。
②______________________________。
【探究三】
实验方案:称量x g铝镁合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。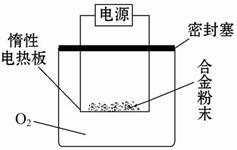
问题讨论:
(1)欲计算镁的质量分数,该实验中还需测定的数据是______。
(2)若用空气(不考虑CO2)代替O2进行实验,对测定结果有何影响? _____(填“偏高”、“偏低”或“无影响”)。
下图是某同学设计的木炭和浓硫酸反应并检验所得产物的实验装置。请回答:
⑴在装置①-④中,有明显错误的一个是(填编号)
⑵写出木炭和浓硫酸反应的化学方程式:。
如果有0.4mol电子转移,则在标准状况下产生气体L。
⑶无水硫酸铜的作用是
⑷装置①中所盛试剂是(填字母),装置④中所盛试剂是(填字母)。
A. 品红溶液 B. 澄清的石灰水 C. 酸性高锰酸钾溶液
(6分)下图表示配制100 mL 0.10 mol·L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题: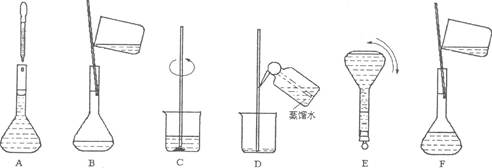
(1)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是。
(2)步骤B通常称为转移,步骤A通常称为。
(3)将上述实验步骤A—F按实验过程先后次序排列。
(8分) 若用右图所示装置测定锌的相对原子质量,
实验步骤如下:
①称量ag纯锌放在铜网中,按图组装后,称得仪器和药品总质量为bg;
②将铜网浸入足量稀盐酸中,充分反应;
③反应完全后,称得仪器和药品总质量为cg。
请填空:
⑴产生H2的质量为----------g.
⑵ 锌的相对原子质量为----------.
⑶实验中碱石灰的作用是-----------------------------------------------,若去掉碱石灰,则测得的锌的相对原子质量-------------------..(偏大、偏小、无影响)
(共10分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO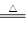 N2+3H2O+3Cu,用示意图中的装置可以实现该反应。回答下列问题:
N2+3H2O+3Cu,用示意图中的装置可以实现该反应。回答下列问题: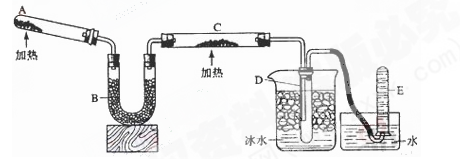
(1)A中发生反应的化学方程式是。检验氨气通常采用的方法及现象是_____________________,。
(2)B中加入的物质是,其作用是。
(3)实验时C中观察到的现象是,该反应中氨的作用是_______剂。
(4)若要检验反应生成的水,可将试管D及烧杯部分改成两个相连的干燥管,第一个干燥管X内装有_____________,现象是___________________;第二个干燥管Y内装有碱石灰,作用是____________________________。
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。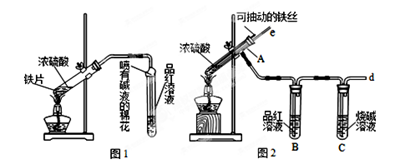
(1)比较两实验装置,图2装置的优点是:
①能更好的吸收有毒气体SO2,防止其污染环境;
②。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是。
(3)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀H2SO4硫酸 | C.KSCN溶液 | D.KMnO4溶液 |
E.NaOH溶液 F.淀粉KI溶液 G.H2O2溶液
验证Ⅲ:步骤1.取试样,滴加少量的(填试剂序号),溶液的颜色变色,则试样中含有Fe3+。
步骤2.再取适量的试样滴加到少量的(填试剂序号),观察到的现象为,则试样中含有Fe2+。