分类法在化学学科的发展中起到重要作用。下列分类标准合理的是( )
| A.根据分散系的稳定性大小将其分为溶液、胶体和浊液 |
| B.根据反应的热效应将化学反应分为放热反应和吸热反应 |
| C.根据溶液导电能力的强弱,将电解质分为强电解质和弱电解质 |
| D.根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 |
下面是某些稠环芳烃的结构简式()
试分析这些式子所表示的化合物种类为()
| A.1种 | B.2种 | C.3种 | D.4种 |
下列说法正确的是( )
| A.所有苯的同系物中滴加3~5滴酸性高锰酸钾溶液,振荡并稍稍加热,均可观察到溶液褪色 |
| B.甘氨酸和丙氨酸脱水,最多可生成3种二肽 |
| C.在高浓度的铜氨溶液中加入脱脂棉,搅拌成黏稠液,用注射器将吸入的黏稠液注入稀盐酸中,将生成物水洗后可获得铜氨纤维 |
| D.欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2并加热 |
绿色化学的核心是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期望的产品中,下列过程不符合这一思想的的是( )
A.甲烷、CO合成乙酸乙酯:2CH4+2CO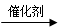 CH3COOCH2CH3 CH3COOCH2CH3 |
B.烯烃与水煤气发生的羰基合成反应:RCH=CH2+CO+ H2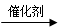 RCH2CH2CHO RCH2CH2CHO |
C.甲烷与氯气反应制氯仿:CH4+3Cl2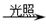 CHCl3+3HCl CHCl3+3HCl |
| D.乙烯合成聚乙烯 |
化学与环境、材料和科技等密切相关。下列说法中错误的是()
| A.积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料 |
| B.光导纤维在信息产业中有广泛应用,制造光导纤维的主要材料是单质硅 |
| C.即将到来的新能源时代,核能、太阳能和氢能等很可能成为主要能源 |
| D.2011年11月3号1时43分神州八号与“天宫一号”完成了首次对接,神八在制造过程中使用了大量的复合材料 |
有关下列两个装置图的说法不正确的是()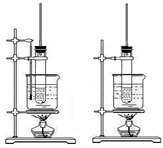
| A.左图可用于实验室制取硝基苯 |
| B.右图可用于实验室制取酚醛树脂 |
| C.长导管是起导气、冷凝回流作用 |
| D.制硝基苯和酚醛树脂均选择浓硫酸作催化剂 |