由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图的转化关系,已知C为密度最小的气体,甲为非电解质。
根据以上转化关系回答下列问题: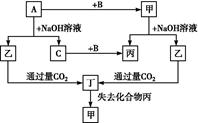
(1)写出下列物质的化学式:A ,B ,丁 。
(2)元素A在周期表中的位置是 ,写出甲的一种用途 。
(3)写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式 。
②乙与过量CO2反应的离子方程式 。
已知
、
、
、
和
都是元素周期表中前36号的元素,它们的原子序数依次增大。
与其他4种元素既不在同一周期又不在同一主族。
和
属同一主族,
和
属同一周期,又知
是周期表中1-18列中的第7列元素。
的原子序数比
小5,
跟
可形成离子化合物其晶胞结构如右图。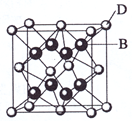
 请回答:
请回答: (1)
元素的名称是;
(1)
元素的名称是; (2)
的元素符号是,
的元素符号是,
与
形成的化合物比
与
形成的化合物沸点高,其原因是
(2)
的元素符号是,
的元素符号是,
与
形成的化合物比
与
形成的化合物沸点高,其原因是 (3)
属元素周期表中第周期,第族的元素,其元素名称是,它的+2价离子的电子排布式为:
(3)
属元素周期表中第周期,第族的元素,其元素名称是,它的+2价离子的电子排布式为: (4)从图中可以看出,
跟
形成的离子化合物的化学式为;该离子化合物晶体的密度为
-3,则晶胞的体积是(只要求列出算式)。
(4)从图中可以看出,
跟
形成的离子化合物的化学式为;该离子化合物晶体的密度为
-3,则晶胞的体积是(只要求列出算式)。
某含苯环的化合物
,其相对分子质量为104,碳的质量分数为92.3%。 (1)
的分子式为:
(1)
的分子式为: (2)
与溴的四氯化碳溶液反应的化学方程式为,反应类型是;
(2)
与溴的四氯化碳溶液反应的化学方程式为,反应类型是; (3)已知:
(3)已知: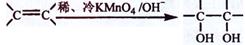 。请写出
与稀、冷的
溶液在碱性条件下反应的化学方程式;
。请写出
与稀、冷的
溶液在碱性条件下反应的化学方程式; (4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式;
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式; (5)在一定条件下,由A聚合得到的高分子化合物的结构简式为。
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为。
下图表示从固体混合物中分离
的2种方案,请回答有关问题。
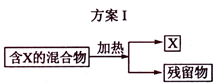
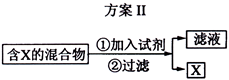
 (1)选用方案I时,
应该具有的性质是,残留物应该具有的性质是;
(1)选用方案I时,
应该具有的性质是,残留物应该具有的性质是; (2)选用方案Ⅱ从某金属粉末(含有
、
和
)中分离
,加入的试剂是,有关反应的化学方程式为;
(2)选用方案Ⅱ从某金属粉末(含有
、
和
)中分离
,加入的试剂是,有关反应的化学方程式为; (3)为提纯某
样品(主要杂质有
、
),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)。
(3)为提纯某
样品(主要杂质有
、
),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)。
电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是
。电池的总反应可表示为:
。 请回答下列问题:
请回答下列问题: (1)电池的负极材料为,发生的电极反应为;
(1)电池的负极材料为,发生的电极反应为; (2)电池正极发生的电极反应为;
(2)电池正极发生的电极反应为;
 (3)
易挥发,实验室中常用
溶液吸收
,有
和
生成。如果把少量水滴到
中,实验现象是反应的化学方程式为;
(3)
易挥发,实验室中常用
溶液吸收
,有
和
生成。如果把少量水滴到
中,实验现象是反应的化学方程式为; (4)组装该电池必须在无水、无氧的条件下进行,原因是。
(4)组装该电池必须在无水、无氧的条件下进行,原因是。
汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物有:
(烃)、
、
、
和
等,请回答下列有关问题 (1)若用
表示汽油的主要组成,
在空气中完全燃烧的化学方程式为,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由能转化为能,最终转化为机械能;
(1)若用
表示汽油的主要组成,
在空气中完全燃烧的化学方程式为,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由能转化为能,最终转化为机械能; (2)通过车用燃油的精炼加工处理,可减少汽车尾气中的(填化学式,多填本空不得分)排放;
(2)通过车用燃油的精炼加工处理,可减少汽车尾气中的(填化学式,多填本空不得分)排放; (3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下
与
反应的化学方程式。
(3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下
与
反应的化学方程式。