A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。 请回答下列问题:
(1)B的原子结构示意图 。
(2)C、D、E三种原子对应的离子半径由大到小的顺序是 (填具体离子);由A、B、C三种元素按4∶2∶3组成的化合物所含的化学键类型为 。
(3)用某种废弃的金属易拉罐与A、C、D组成的化合物溶液反应,该反应的离子方程式为: 。
(4)在100 mL 18 mol/L的浓的A、C、E组成的酸溶液中加入过量的铜片,加热使之充分反应, 产生的气体在标准状况下的体积可能是 (填序号);
a.7.32 L b.6.72 L c.20.16 L d.30.24 L
若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,反应的离子方程式为: 。
(5)A、C两元素的单质与熔融K2CO3组成的燃料电池,其负极反应式为 ,用该电池电解1 L 1 mol/L NaCl溶液当消耗标准状况下1.12 L H2时,NaCl溶液的pH= (假设电解过程中溶液的体积不变)。
 下边是日照2
下边是日照2 010年9月11日的空气质量日报
010年9月11日的空气质量日报
| 污染指数 |
首要污染物 |
空气质量级别 |
空气质量状况 |
||
| 二氧化硫 |
二氧化氮 |
可吸入颗粒物 |
|||
| 12 |
33 |
66 |
2 |
良 |
(1)首要污染物是
(2)污染指数是
(3)能引起光化学烟雾的是(从表中选)
(4)能引起酸雨的是(从表中选)
丁基橡胶可用于制造汽车内胎,合成丁基橡胶的一种单体A的分子式为C4H8,A与H2加成后得到2—甲基丙烷。完成下列填空:
(1)写出A的结构简式 (2)写出将A通入下列两种溶液后出现的现象。
(2)写出将A通入下列两种溶液后出现的现象。
A通入溴水,A通入溴的四氯化碳溶液
(3)写出分子式为C4H8的烯烃除A以外的同分异构体。
(4)A与某烷烃发生反应生成分子式为C8H18的物质B,B的一卤代物只有4种,且碳链不对称。写出B的结构简式
 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H0。(填“>、<或=”下同)
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H0。(填“>、<或=”下同)
(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的倍。
(3)利用甲醇燃料电池设计如图所示的装置:
①则该装置中b为极,写出装置中电解池内发生反应的离子方程式,
②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为L。
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)="=" C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)="=" C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式。
物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)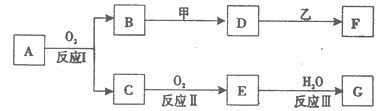
回答下列问题:
(l)第一种情况:用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。则:
①反应Ⅲ的化学方程式为__________________________________________。
②D与乙反应的离子方程式为____________________________________
(2)第二种情况:甲由两种单质直接化合得到;B 为红棕色固体; C为无色气体,是形成酸雨的大气污染物之一 ;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
①工业上,反应 I的化学方程式为______________________________________
生产设备名称为:
②D和乙反应的离子方程式为____________________________________
③请简述检验D溶液中阳离子的方法。
④若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数=(列出计算式即可)。
A、B、C、D、E、F六种短周期元素,原子序数依次增大,A、E同主族,D、F同主族,A元素的原子半径是所有原子中最小的,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与 其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)F元素在周期表中的位置,,在以上元素最高价氧化物的水化物中,碱性最强的化合物的电子式是:。
(2)D、F的气态氢化物,沸点较高的是(填分子式)。
(3)A单质与C单质在一定条件下可化合为Z,常温下,向pH=a的Z的水溶液中加入等体积pH=b的X的水溶液,且a+b=14, 充分作用后,溶液pH7(填“>”“<”或“=”),原因是
充分作用后,溶液pH7(填“>”“<”或“=”),原因是 。
。