现有0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大;②c(NH3·H2O)增大;③N 数目增多;④c(OH-)增大;⑤导电性增强;⑥
数目增多;④c(OH-)增大;⑤导电性增强;⑥ 增大
增大
| A.①②③ | B.①③⑤ | C.①③⑥ | D.②④⑥ |
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是
| A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑ |
| B.K1闭合,石墨棒周围溶液pH逐渐升高 |
| C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D.K2闭合,电路中通过0.4NA个电子时,两极共产生标况下4.48L气体 |
利用图中所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
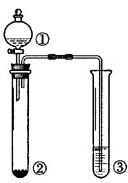 |
| A |
浓盐酸 |
MnO2 |
NaOH |
制氯气并吸收尾气 |
|
| B |
浓硫酸 |
蔗糖 |
溴水 |
浓硫酸具有脱水性、氧化性 |
|
| C |
稀盐酸 |
Na2SO3 |
Ba(NO3)2溶液 |
SO2与可溶性钡盐均可生成白色沉淀 |
|
| D |
浓硝酸 |
Na2CO3 |
Na2SiO3溶液 |
酸性:硝酸>碳酸>硅酸 |
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是
| A.Y的气态简单氢化物的热稳定性比W的强 |
| B.X的最高价氧化物对应水化物的酸性比W的弱 |
| C.Y分别与Z、W形成的化合物均为碱性氧化物 |
| D.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
在标准状况下,将aLNH3完全溶于水得到V mL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为Cmol/L。下列叙述中正确的是
①ω=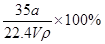
②C=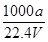
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为: c(Cl-) >c(NH4+) >c(H+) >c(OH-)
| A.①④ | B.②③ | C.①③ | D.②④ |
将4 mol金属Al全部转化为Al(OH)3,过程中共消耗HCl a mol、NaOH b mol,则a+b最小值为
| A.4 | B.6 | C.8 | D.16 |