电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤: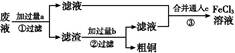
写出一个能证明还原性Fe比Cu强的离子方程式: 。
该反应在上图步骤 中发生。请根据上述反应设计一个原电池,在方框中画出简易装置图(标出电极名称、电极材料、电解质溶液)。
| |
上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及主要的电极反应式 。
随着科学技术的不断发展,阿伏加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:①将NaCl固体细粒干燥后,准确称取m g NaCl固体细粒并转移到定容仪器A中;②用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积V cm3。请回答:
(1)步骤①中仪器A最好使用(填序号)。
| A.量筒 | B.烧杯 | C.容量瓶 | D.试管 |
(2)步骤②中是否用酸式滴定管还是用碱式滴定管,理由是。
(3)已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm,则用上述方法测得的阿伏加德常数NA的表达式为。(NaCl的相对分子质量用M表示)
锡有白锡和 灰锡两种单质,常见的白锡银白色有金属光泽,密度7.31g/cm3,软而富有展性,导电导热能力强,在13.2℃---161℃间稳定。白锡剧冷转变为粉末状的灰锡;灰锡暗灰色固体或粉末,密度5.75g/cm3,无延展性,导电导热能力差,13.2℃以下稳定,较少应用。结构研究表明,白锡晶体中锡原子为六方最密堆积,灰锡的结构类似于金刚石。根据以上信息回答下列问题:
灰锡两种单质,常见的白锡银白色有金属光泽,密度7.31g/cm3,软而富有展性,导电导热能力强,在13.2℃---161℃间稳定。白锡剧冷转变为粉末状的灰锡;灰锡暗灰色固体或粉末,密度5.75g/cm3,无延展性,导电导热能力差,13.2℃以下稳定,较少应用。结构研究表明,白锡晶体中锡原子为六方最密堆积,灰锡的结构类似于金刚石。根据以上信息回答下列问题:
①六方最密堆的配位数是,和六方最密堆的配位数相同的另一堆积叫。
②白锡和灰锡的关系是,白锡转化为灰锡的变化属。
③白锡属晶体,灰锡属晶体。
④根据金属的导电机理分析灰锡导电能力差的原因。
⑤从晶格能的影响因素角度分析金刚石稳定,灰锡不稳定的原因。
(6分)向20mL某物质的量浓度的AlCl3溶液中滴入2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所加NaOH溶液体积(mL)的关系如图所示,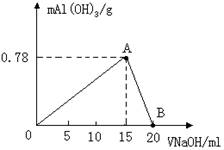
试回答下列问题:
(1)图中A点表示的意义是___________
(2)图中B点表示的意义是___________
(3)上述两步总反应用总的离子方程式可表示为:___________
(4)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为___________(写出计算过程)
下图表示的反应关系中,部分产物被略去,已知2mol白色固体粉末X受热分解,恢复到室温生成A(白色固体)、B、C各1mol , X、E、G的焰色反应均为黄色。回答下列问题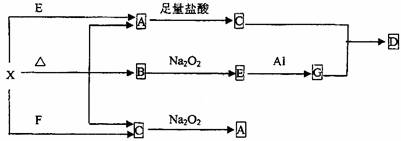
(1)写出下列物质的化学式:X,G,D
(2)写出G与C反应生成D的离子方程式____________________________
(3)写出X+E→A的离子方程式___________________________________
(4)写出C与Na2O2反应的化学方程式_________________________________
若有0.2mol Na2O2参加反应,则转移的电子数为__________________
将一小快金属钠投入到盛放FeCl2溶液的烧杯中,观察到的现象是__________________有关的离子方程式是____________________。