元素H、C、N、O、F都是重要的非金属元素,Fe、Cu是应用非常广泛的金属。
(1)Fe元素基态原子的核外电子排布式为 。
(2)C、H元素形成的化合物分子中共有16个电子,该分子中σ键与π键的个数比为 。
(3)C、N、O三种元素的第一电离能由大到小的顺序为(用元素符号表示) 。
(4)在测定HF的相对分子质量时,实验测得值一般高于理论值,其主要原因是 。
(5)C、N两元素形成的化合物C3N4形成的原子晶体,结构类似金刚石,甚至硬度超过金刚石,其原因是 。
(6)如图为石墨晶胞结构示意图,该晶胞中含有C原子的个数为 。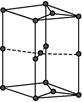
Ⅰ.(1)以下物质:①液氨 ②碳酸钙③酒精 ④饱和食盐水 ⑤铜 ⑥硫酸 ⑦盐酸,属于电解质的有 (填编号);属于非电解质的有_____________;
(2)19.6g H2SO4分子所含氢原子数与 L (标准状况下)CH4所含氢原子数相等;
Ⅱ.有A、B、C三种元素,已知A元素原子的K层和M层电子数相同;B元素原子的L层比K层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数。
(1)写出A的原子结构示意图________;元素C的原子核组成符号________。
(2)B的阴离子结构示意图________;A、B组成的化合物的化学式。
(12分)某化学课外小组为测定空气中CO2的含量,进行了如下实验:
(1)配制0.100 0 mol·L-1和0.010 00 mol·L-1的标准盐酸。
(2)用0.100 0 mol·L-1的标准盐酸滴定未知浓度的Ba(OH)2溶液10.00 mL,结果用去盐酸19.60 mL。
(3)用测定的Ba(OH)2溶液吸收定量空气的CO2。取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里,加水至刻度线。取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀。
(4)过滤上述所得浊液。
(5)取滤液20.00 mL,用0.010 00 mol·L-1的盐酸滴定,用去盐酸34.80 mL。请回答下列问题:
①配制标准盐酸时,需用下列哪些仪器________;
| A.托盘天平 |
| B.容量瓶 |
| C.酸式滴定管 |
| D.量筒 |
E.烧杯
F.胶头滴管
G.玻璃棒
②滴定操作中,左手__________,右手__________,眼睛________________________。
③Ba(OH)2溶液的物质的量浓度是________________________________________;
④过滤所得浊液的目的是_________________________________________________;
⑤此空气样品中含CO2的体积分数为______________________________________。
在一定温度下,将2 mol A和1 mol B两种气体相混合于体积为2 L的某密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g)+2D(g)ΔH<0,2 min末反应达到平衡状态(温度不变),生成了1mol D,并测得C的浓度为0.5 mol·L-1,请填写下列空白:
xC(g)+2D(g)ΔH<0,2 min末反应达到平衡状态(温度不变),生成了1mol D,并测得C的浓度为0.5 mol·L-1,请填写下列空白:
(1)x的值等于________________。
(2)该反应的化学平衡常数K=________,升高温度时K值将________(选填“增大”、“减小”或“不变”)。
(3)A物质的转化率为__________________。
(4)若维持温度不变,在原平衡混合物的容器中再充入2mol C和2mol D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入A的物质的量为________ mol。
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,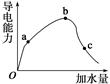
请回答:
(1)O点为什么不导电:_______________________________。
(2)a、b、c三点溶液的pH由小到大的顺序是______________。
(3)H+的物质的量最大的是________(填“a”、“b”或“c”)。
(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的________(填序号)。
| A.加热 | B.加很稀的NaOH溶液 |
| C.加NaOH固体 | D.加水 |
E.加入锌粒
(1)若把H2O2看成是二元弱酸,请写出在水中的电离方程式:_________________________________
(2)碘也可用作心脏起搏器电源——锂碘电池的材料。该电池反应为2Li(s)+I2(s)==="2LiI(s)" ΔH
已知:①4Li(s)+O2(g)===2Li2O(s) ΔH1 ②4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2则电池反应的ΔH=__________
(3)某温度时,在2 L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。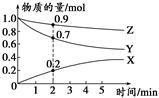
由此分析,该反应的化学方程式为___________________________________;从反应开始至2 min时,Z的反应速率为____________。
(4)在某温度时,测得0.01 mol·L-1的NaOH溶液的pH=10。在此温度下,将1mL 0.1mol/L KOH溶液加水稀释至1L,则溶液的pH为,若加水稀释至1000L,则溶液的pH为。