口服抗菌药利君沙的制备原料G和某种广泛应用于电子电器等领域的高分子化合物Ⅰ的合成路线如下:
已知:①R—CH2—CH===CH2 R—CHCl—CH===CH2
R—CHCl—CH===CH2
②R—CH2—CH===CH2 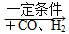 R—CH2CH2CH2CHO
R—CH2CH2CH2CHO
(1)A的结构简式是________,D中的官能团的名称是________。
(2)写出B―→C的化学方程式:___________________________________________,
该反应类型是____________________。
(3)H的分子式为C8H6O4,能与碳酸钠溶液反应放出气体,其一氯取代物只有一种,写出H的结构简式:_____________________________________________________
(4)写出E+H―→I的化学方程式:______________________________。
(5)J是比C多一个碳原子的C的同系物,J可能的稳定结构有________种(①考虑顺反异构;②“ ”结构不稳定),请任意写出其中一种的结构简式:______________。
”结构不稳定),请任意写出其中一种的结构简式:______________。
(6)关于G的说法中正确的是________(填序号)。
a.1 mol G可与2 mol NaHCO3反应
b.G可发生消去反应
c.1 mol G可与2 mol H2发生加成反应
d.G在一定条件下可与Cl2发生取代反应
近几年全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(下图中V(正)、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)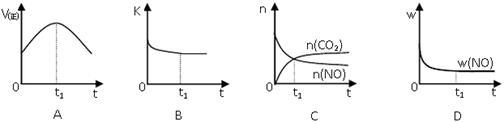
(2)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g) 
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中在1L恒容容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中在1L恒容容器内各物质的浓度随时间变化的曲线。回答下列问题: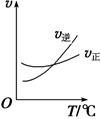

①0—6 min内,反应的平均速率v(Cl2)= ;
②若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”);
③若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)= mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
④随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”);
⑤比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)________T(15) (填“<”、“>”或“=”)。
(3)用NH3催化还原NOX也可以消除氮氧化物的污染。下图E,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g) + NO2(g) + 2NH3(g) 2N2(g) + 3H2O(g)。
2N2(g) + 3H2O(g)。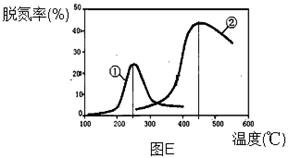
①该反应的△S 0,△H 0(填“>”、“=”或“<”)。
②以下说法正确的是 。
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
③已知:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O;NO + NO2 + 2NaOH = 2NaNO2 + H2O标况下V升NO和NO2的混合气体通100mLNaOH溶液恰好完全反应,则NO和NO2的体积比是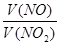 ,NaOH的物质的量浓度为_______(用含V的数学表达式表示,反应后的溶液呈______性(填“酸”、“碱”或“中”)
,NaOH的物质的量浓度为_______(用含V的数学表达式表示,反应后的溶液呈______性(填“酸”、“碱”或“中”)
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达平衡后,再通入一定量N2O5,则N2O5的转化率将_______。(填““增大”“减小”或“不变”);
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1 000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为_________________。
③在T2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2___________T1。
(2)下图所示装置可用于制备N2O5,则N2O5在电解池的_________区生成,其电极反应式为_________________。
Ⅰ恒温、恒压下,在一个可变容积的容器中发生如下反应: A(气)+B(气) C(气)。
C(气)。
(1)若开始时放入1 mol A和1 mol B,到达平衡后,生成a mol C,这时A的物质的量为 mol,
(2)若开始时放入3 mol A和3 mol B,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x mol A、2 mol B和1 mol C,到达平衡后,A和C的物质的量分别是y mol和3a mol,则x= mol,y= mol。平衡时,B的物质的量 (选填一个编号)。
(甲)大于2 mol(乙)等于2 mol
(丙)小于2 mol(丁)可能大于、等于或小于2 mol
Ⅱ若维持温度不变,在一个与(Ⅰ)反应前起始体积相同、且容积固定的容器中发生上述反应。
(4)开始加入1 mol A和1mol B 时A的转化率为m,若开始时加入1 mol A和2 mol B 时A的转化率为n,则m n(“>”、“<”、“=”)
(5)开始时放入1 mol A和1 mol B到达平衡后生成b mol C。将b与(1)小题中的a进行比较____(选填一个编号)。
(甲)a<b(乙)a>b(丙)a="b" (丁)不能比较a和b的大小
氯气在298K、100kPa时,在1L水中溶解0.09mol即达饱和,实验测得溶于水的Cl2有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为_____ _____; 计算上述体系的平衡常数_____ 。
(2)若在该饱和氯水中①加入少量NaOH固体,平衡将向________移动,溶液的pH值将 (“增大”、 “减小”、“不变”);②通入适量氯气平衡将________移动。(填“向左”、“向右”、“不移动”)
(3)如果增大氯气的压强,平衡将向_________移动(填“左”、“右”)。氯气在水中的溶解度将______。(填“增大”、“减小”或“不变”),参与反应的氯气与溶解氯气的比值将______1/3(填“大于”、“小于”或“等于”)。
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期。A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子。请回答下列问题:
(1)A、B、C三种元素第一电离能最大的是(填元素符号)______,基态E原子的电子排布式为______。
(2)C、D的简单氢化物中沸点较高的是__________(填分子式),原因是____________。
(3)A元素可形成多种单质,其中分子晶体的分子式为______________,原子晶体的名称是 ;A的一种单质为层状结构的晶体(如图),其原子的杂化轨道类型为______________。
(4)①化合物DC2的立体构型为______________,中心原子的价层电子对数为 。
②用KMn04酸性溶液吸收DC2气体时,MnO4-被还原为Mn2+,该反应的离子方程式为______________。
(5)D与E能形成化合物X,X的一种晶体晶胞结构如图所示,X的化学式为 ,E的配位数为________________;若晶胞边长为a,则晶体E的密度计算式为ρ= 。