原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期。A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子。请回答下列问题:
(1)A、B、C三种元素第一电离能最大的是(填元素符号)______,基态E原子的电子排布式为______。
(2)C、D的简单氢化物中沸点较高的是__________(填分子式),原因是____________。
(3)A元素可形成多种单质,其中分子晶体的分子式为______________,原子晶体的名称是 ;A的一种单质为层状结构的晶体(如图),其原子的杂化轨道类型为______________。

(4)①化合物DC2的立体构型为______________,中心原子的价层电子对数为 。
②用KMn04酸性溶液吸收DC2气体时,MnO4-被还原为Mn2+,该反应的离子方程式为______________。
(5)D与E能形成化合物X,X的一种晶体晶胞结构如图所示,X的化学式为 ,E的配位数为________________;若晶胞边长为a,则晶体E的密度计算式为ρ= 。

(9分) 在一定体积的密闭容器中,进行如下可逆化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=;
(2)能判断该反应是否达到化学平衡状态的依据是(多选扣分)。
A.容器中压强不变 B.混合气体中 c(CO)不变
C.V正(H2O)= V逆(H2O) D.c(CO2)= c(CO)
(3) 800℃时,反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=。
CO2(g)+H2(g)的平衡常数K=。
(1)已知1.0mol·L—1NaHSO3溶液的pH为3.5,则此溶液离子浓度从大到小的顺序为
(用离子符号表示)。
(2)能证明Na2SO3溶液中存在水解平衡SO32-+H2O HSO3-+OH-的事实是(填序号)。
HSO3-+OH-的事实是(填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液红色退去
B.滴入酚酞溶液变红,再加入氯水后红色退去
C.滴入酚酞溶液变红,在加入BaCl2溶液后产生沉淀且红色退去
(3)工业上利用催化氧化反应将SO2转化为SO3:2SO2+ O2 2SO3。若某温度下,此反应的起始浓度c(SO2)=1.0mol·L—1,c(O2)=1.5mol·L—1,达到平衡后,SO2的转化率为50%,则此温度下该反应的平衡常数K=。
2SO3。若某温度下,此反应的起始浓度c(SO2)=1.0mol·L—1,c(O2)=1.5mol·L—1,达到平衡后,SO2的转化率为50%,则此温度下该反应的平衡常数K=。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+=I2+5SO42-+H2O。生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间衡量该反应的速率。某同学设计实验如下表所示:
| 0.01mol/LKIO3酸性溶液(含淀粉)的体积/mL |
0.01mol·L-1 Na2SO3溶液的体积/mL |
H2O的体积/mL |
实验温度 /℃ |
溶液出现蓝色时所需时间/s |
|
| 实验1 |
5 |
V1 |
35 |
25 |
|
| 实验2 |
5 |
5 |
40 |
25 |
|
| 实验3 |
5 |
5 |
V2 |
0 |
表中V2=___________mL,该实验的目的是____________________。
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0。已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0。已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值(填“增大”、“减小”或“不变”);
②1100 ℃时测得高炉中,c(CO2)="0.025" mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应向进行(填“左”或“右”),判断依据是。
(2)目前工业上也可用CO2生产燃料甲醇,有关反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
①该反应的化学平衡常数表达式为;
②反应达到平衡时,氢气的转化率 α(H2)=;
③反应达到平衡后,下列措施能使 增大的是(填序号)。
增大的是(填序号)。
A升高温度B再充入H2C再充入CO2
D 将H2O(g)从体系中分离 E.充入He(g)
已知某溶液中只存在OH-、H+、NH4+、Cl- 四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是(填化学式),上述四种离子浓度的大小顺序为(填序号),用离子方程式表示呈现该顺序的原因 。
(2)若四种离子的关系符合③,则溶质为(填化学式);若四种离子的关系符合④,则溶质为
(填化学式);
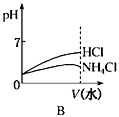
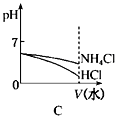
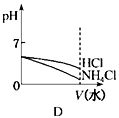
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)c(NH3•H2O)(填“>”或“<”或“=”,下同),混合前酸中的c(H+)碱中c(OH-);
(4)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下列图象正确的是(填选项)。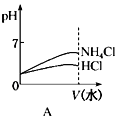
在2L密闭容器中,800℃时反应2NO(g)+O2(g)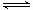 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=____________。
已知:K(300℃)>K(350℃),该反应是________热反应。
(2)右图中表示NO2的变化的曲线是_____。用O2表示从0~2s内该反应的平均速率v=___________。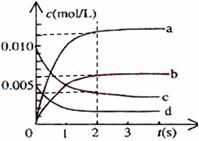
(3)能说明该反应已经达到平衡状态的是_________。
a、v(NO2)=2v(O2)b、容器内压强保持不变
c、v逆(NO)=2v正(O2) d、容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a、及时分离出NO2气体b、适当升高温度
c、增大O2的浓度d、选择高效的催化剂