在2L密闭容器中,800℃时反应2NO(g)+O2(g)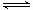 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=_________ ___。
已知:K(300℃)>K(350℃),该反应是________热反应。
(2)右图中表示NO2的变化的曲线是_____。用O2表示从0~2s内该反应的平均速率v=___________。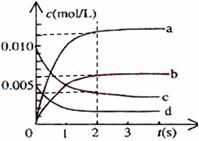
(3)能说明该反应已经达到平衡状态的是_________。
a、v(NO2)=2v(O2) b、容器内压强保持不变
c、v逆(NO)=2v正(O2) d、容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a、及时分离出NO2气体 b、适当升高温度
c、增大O2的浓度 d、选择高效的催化剂
等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示: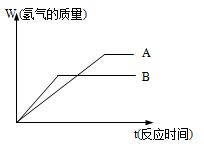
(1 ) 两种金属的活动性顺序是_____>______
) 两种金属的活动性顺序是_____>______
两种金属氯化物的摩尔质量是_____>______
(2) 将两种金属粉末按一定比例混合后,进行甲、乙
丙三组实验,三组实验各取500mL同浓度的盐酸
溶液加入该种混合粉末,产生气体,有关数据如下:
| 实验序号 |
甲 |
乙 |
丙 |
| 混合粉末质量(g) |
6.2 |
18.6 |
24.8 |
| 生成气体气体(mL) |
2240 |
5600 |
5600 |
①乙组实验中,盐酸________(填“过量”、“适量”或“不足量”)
②上述所用的盐酸的物质的量浓度为_____mol/L,混合粉末的平均摩尔质量是________。
(12分)
在盛有AgNO3、HCl、Na2CO3、CaCl2、NaCl五种无色溶液的试剂瓶上,分别贴有①~⑤的编号。将它们两两混合,产生的现象如表所列(其中“↑”表示产生气体,“↓”表示生成沉淀,“—”表示无现象):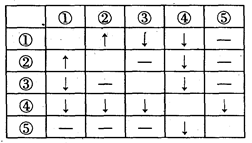
(1)写出③、④、⑤三种物质的化学式为:
③______________,④_____________,⑤_______________。
(2)写出下列反 应的离子方程式:①+②__________________________。
应的离子方程式:①+②__________________________。
(6分)
CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2L(标准状况)。试回答:(1)混合气体中CO的质量是。(2)混合气体中CO2在标准状况下的体积是。(3)混合气体在标准状况下的密度是。
(1)在Fe3O4 +4CO 3Fe+4CO2的反应中,是氧化剂,
3Fe+4CO2的反应中,是氧化剂,
是还原剂,元素被氧化,元素被还原。
(2)配平下列化学方程式并用单线桥法分析下列氧化还原反应中电子转移的方向和数目,
Cu +HNO3(浓)— Cu(NO3)2 + NO2↑ +H2O
浓硝酸表现出来的性质是_______________(填写编号)。
①还原性②酸性③氧化性
(6分)
我国政府为了消除碘缺乏病,规定在食盐中必须加人适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2 SO4====3K2SO4+3I2+3H2O
SO4====3K2SO4+3I2+3H2O
(1)用“双线桥”表示出上述反应中电子转移的方向和数目
________________________________________。
(2)如果反应中转移0.2mol电子,则生成I2的物质的量为_________________。
(3)利用上述反应检验食 盐中是否加碘,所需试剂是______________(填下列选项的序号)
盐中是否加碘,所需试剂是______________(填下列选项的序号)
①碘水②KI溶液③淀粉溶液④稀硫酸⑤AgNO3溶液