(08朝阳统一测试,27)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
____________________________________________ 。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•x H2O),反应的化学方程式:
____________________________________________ 。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,
溶液中发生的化合反应的化学方程式______________________________ 。
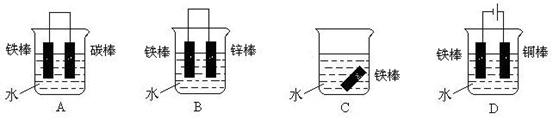
(4)下列哪个装置可防止铁棒被腐蚀_____________ 。
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
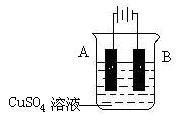
请回答:
① A电极对应的金属是______(写元素名称),B电极的电极反应式是 。
② 若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二
者质量差为5.12 g,则电镀时电路中通过的电子为________________mol。
③ 镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| 称取A 9.0 g,升温使其汽化,测其密度 是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为:________。 |
| 将此9.0 g A在足量纯O2中充分燃烧,并 使其产物依次缓缓通过浓硫酸、碱石灰, 发现两者分别增重5.4 g和13.2 g |
(2)A的分子式为:________。 |
| 另取A 9.0 g,跟足量的NaHCO3粉末反应, 生成2.24 L CO2(标准状况),若与足量金 属钠反应则生成2.24 L H2(标准状况) |
(3)写出A中含有的官能团: (写结构简式) ________________________________________________________ |
(4)A的核磁共振氢谱如下图: |
(4)A中含有________种氢原子。 |
(5)综上所述,A的结构简式为________。 |
(6分)某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间连线代表单键、双键等化学键)。
(1)该物质的结构简式为______________________________________________。
(2)下列物质中,与该产品互为同系物的是(填序号)________,互为同分异构体的是__________。
(8分)A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如下所示:



ABCD
(1)化合物A中含有的官能团的名称是;
(2)A、B、C、D四种化合物中互为同分异构体的是(填序号);
(3)化合物B的核磁共振氢谱中出现组峰;
(4)1mol D最多能与mol的氢气发生加成反应;
现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为________个。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为___。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____g·mol-1。
4.8 g O2和0.2 mol CO2,它们的物质的量之比是________,质量之比是________,在同温同压下的体积之比是________。