感冒是一种常见的病,人患了感冒会咳嗽、流涕、发烧,多喝开水多休息,适当服用一些治疗感冒的药,可以舒缓症状,减轻病情。
(1)药物阿司匹林是一种传统的治疗感冒发烧的老药,从分子结构上看,它可以看作是乙酸酯,其结构简式如下图: 
作为一种解热镇痛药,对于感冒发烧,它有较好的疗效,但大剂量长期空腹服用,容易对胃肠道产生刺激,原因是阿司匹林在胃中会发生酯的水解反应,生成_________和_________(用结构简式表示),阿司匹林分子水解后,能电离出氢离子(H + )的官能团增多,增大了对胃肠道的刺激。
(2)为减小副作用,一般宜饭后服药,并同时服用少量辅助药物,在①硫酸镁、②氢氧化钡、③碳酸钙中选取哪一种?
(14分) A、B、C、D、E是原子序数依次增大的短周期主族元素,A、D在周期表中的相对位置如下表;A元素最低负化合价的绝对值与其原子最外层电子数相等;C是地壳中含量最多的金属元素。
| A |
||||
| D |
(1)A与氢元素组成的化合物分子有6个原子,其结构简式为_____________,写出该化合物在常温下使溴水褪色的化学方程式______________________________,该化合物还是一种重要的化工原料,写出其加聚生成高分子的化学方程式:____________________________。
(2)B元素的最高氧化物对应的水化物与它的氢化物反应得到离子化合物,则B元素的单质分子空间构型为___________,写出该单质的一种等电子体:_________________。
(3)C的离子结构示意图为____________,元素E在周期表中的位置是_________________。
(14分)A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族.B、C、D的最高价氧化物的水化物均能互相反应生成盐和水.A和E可形成离子化合物,其晶胞结构如下图所示: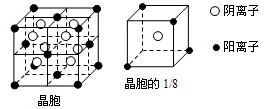
(1)A、C、D、E四种元素依次是____ ____ ____ ____ (用元素符号表示)。
(2)上述四种元素ABCD中第一电离能最小的是________电负性最大的是________其原子半径由小到大的顺序为________________(均用元素符号表示)。
(3)A和D的氢化物中,前者沸点较高,原因是________________________________。
(4)A和E的化合物晶体中,每个阳离子的周围与它最近且等距离的阳离子共有个________。
(12分)下列物质:①H2②HF ③H2O2 ④KF ⑤NH4Cl ⑥C2H2⑦N2H4+⑧BF3⑨H2O ⑩N2(填序号)
(1)只含非极性键的是___________________
(2)只含极性键的极性分子是_____________
(3)既有极性键又有非极性键的是_________
(4)只有σ键的是_______________________
(5)既有σ键又有π键的是_______________
(6)含有配位键的是_____________________
(14分)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是_________________________,该化合物由________键形成。
(2)Na3N与盐酸反应生成________种盐,其电子式分别是
________________________________,________________________________。
(3)Na3N与水的反应属于________(填基本反应类型)反应。
(4)比较Na3N中两种粒子的半径:r(Na+)________ (填“>”“=”“<”) r(N3-)。
(14分)分析下图,回答以下问题: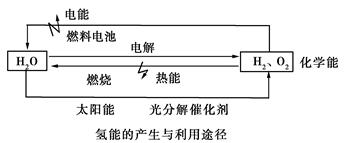
(1)水电解生成H2,首先要解决的问题是________________________________。
(2)氢气作为理想的“绿色能源”除了来源丰富,还有哪些优点:
①________________________________,②_____________________________。
(3)氢氧燃料电池是氢能源利用的一个重要方向,氢气在________极上发生________反应。若电解质溶液为KOH溶液,写出正负极上的电极反应:
正极________________________________,负极________________________________。