(12 分)某课外活动小组通过实验探究某溶液的溶质可能由下列一种或几种离子构成:
Ba2+、Na+、Fe3+、Cu2+、CO32-、AlO2-、SO32-、SO42-。取该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH)2溶液,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成份,而且各不相同。
请回答下列问题:
(1)只根据实验①能得出的结论是 ;
(2)该溶液中肯定存在的离子有_________。可能含有________。怎么用化学方法检验该离子的存在____________________________。(写出操作方法、现象、结论)
(3)向溶液甲中加入NH4HCO3溶液至过量,该过程中发生的离子方程式为:
、 。
硫酸钡是惟一无毒的钡盐,工业上以BaSO4等为原料通入图所示流程反应可以制备锌钡白和过氧化氢: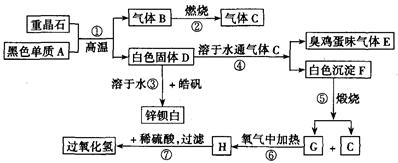
(1)上述流程中共有7个化学反应,其中有__________个属于氧化还原反应。
(2)写出过氧化氢的电子式:__________;写出物质H的电子式:__________。
(3)写出下列化学反应方程式:
反应①:____________________;
反应③:____________________;
反应④:____________________;
反应⑦:____________________。
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,B跟Cl2反应除生成C外,另一产物是盐酸盐。
用化学式号填写下列空格:
(1)A是__________。
(2)当X是强酸时,A、B、C、D、E、F均含同一种元素,F是__________。
(3)当X是强碱时,A、B、C、D、E、F均含同一种元素,F是__________。
(4)B跟Cl2反应的化学方程式是________________________________________。
图中①~⑩分别代表有关反应中的一种物质,它们均是中学化学中常见物质。已知①~③和⑥~⑩中分别含有同一种元素。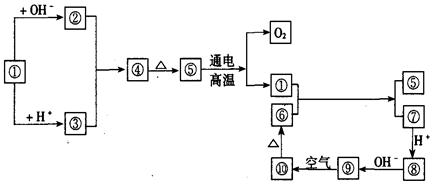
(1)分别写出①、④、⑧的化学式或离子符号:
①_________,④_________,⑧_________。
(2)写出下列反应方程式,是离子反应的写出离子方程式:
|
①+OH—→________________________________
|
⑤-→________________________________
①+⑥—→________________________________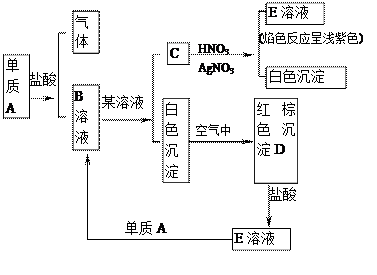
根据图指出A、B、C、D、E各是什么物质?
有机物A的化学式为C6H8O4Cl2,与有机物B、C、D、E的变化关系如下图:
1molA经水解生成2molB和1molC,根据上述变化关系填空:
(1)写出物质的结构简式:A 、 B 、 C 、D 、 E 。
(2)写出E转变为B的化学方程式: 。