(1)下列五组物质,每组中有一种物质从某种分类法的角度分析与其他四种不同,请找出该物质,并说明理由。[例如Fe、S、C、P:Fe(金属)]
①CuSO4、Fe(NO3)3、KMnO4、K2CO3________________;
②AgCl、BaSO4、KNO3、Ca(ClO)2_____________________。这种分类法是________________。
(2)乙醇钠(C2H5ONa)能溶于乙醇,将乙醇钠固体从其乙醇溶液中提取出来的方法是 ;除去KNO3溶液中的I2杂质,主要操作步骤是 。
(3)配制浓度为1:5(98%的浓硫酸和水的体积比)的稀硫酸,需要用到的玻璃仪器有 。
(4)臭氧与碘化钾溶液反应的化学方程式为:O3+2KI+H2O==O2+2KOH +I2;其中还原产物与氧化产物物质的量之比是 ,若有0.5mol氧气生成,电子转移总数为 。
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平, A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题: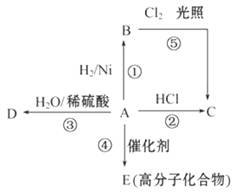
(1)写出A、B、C、D的结构简式:
A__________________________________________,
B__________________________________________,
C__________________________________________,
D__________________________________________。
(2)写出②、④、⑤三步反应的化学方程式,并注明反应类型:
②________________________________________,反应类型________________。
④________________________________________,反应类型________________。
⑤________________________________________,反应类型________________。
(12分)已知有以下物质相互转化
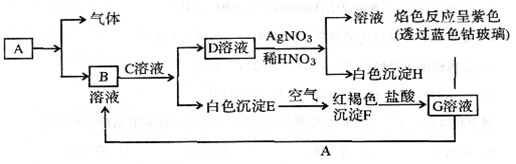
试回答:
(1)写出B的化学式__________;D的化学式__________。
(2)写出由E转变成F的化学方程式_______________________________。
(3)写出用KSCN鉴别G溶液的现象_________;向G溶液加入A的有关离子反应方程式_________________________________________。
胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末;(2)能溶于水,水溶液呈弱碱性;(3)受热分解;(4)遇酸及酸性药物则产生二氧化碳;(5)胃酸过多患者服用后多见胃胀气,甚至有引起溃疡穿孔的危险。
乙:(1)与胃酸的中和作用缓慢持久,可维持3~4小时;(2)凝胶本身覆盖于溃疡面上,具有保护作用,并能吸附H+;(3)可溶于稀酸或氢氧化钠溶液。
(1)请你推测,甲中含有的主要化学成分是(填化学式,下同);乙中含有的主要化学成分是。
(2)写出甲中含有的主要化学成分引起胃胀气的离子方程式______________________。
(3)写出乙中含有的主要化学成分分别与稀盐酸和氢氧化钠溶液反应的离子方程式__________________________________、_________________________________。
(1)明矾晶体可用来净水,它的化学式为。
(2)反应KClO3+6HCl=KCl+3Cl2↑+3H2O 中氧化剂是氧化剂和还原剂的物质的量之比:_______。
(3)加热10.0g碳酸钠和碳酸氢钠的混合物至质量不在变化,剩余固体的质量为8.45g,则混合物中碳酸钠的质量分数为。(填能或者不能)用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液。
A、B、C、D四种可溶性盐,阳离子分别可能是Ba2+、Na+、Ag+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-中的某一种。根据你所学习的知识回答下列问题:①把四种盐分别溶于盛有蒸馏水的试管中,只有C盐的溶液呈蓝色。②向①的四支试管中分别加入盐酸,B盐有沉淀生成,D盐有无色无味气体溢出。
(1)四种盐的化学式分别为:A、_______;B、___________;C、__________;D、________。
(2)写出A与B、A与C反应的离子方程式:
A+B:;A+C: