【化学——选修2:化学与技术】
普通纸张的主要成分是纤维素。在早期的纸张生产中,常采用纸张表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散。请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存,经分析检验,发现酸性腐蚀主要与造纸中涂明矾的工艺有关,其中的化学原理是 ;为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等。这样操作产生的问题是 ;
②喷洒 Zn(C2H5 )2 • Zn(C2H5 )2可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理 、 。
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾。钛白粉的一工业制法是以钛铁矿(主要成分为FeTiO3)为原料按下列过程进行的,请完成下列化学方程式: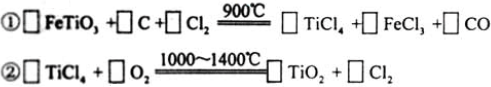
有的油田开采的石油中溶有一种碳氢化合物——金刚烷,它的分子立体结构如图所示: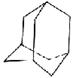
(1)由图可知其分子式为:____________,一氯代物有_______种。
(2)它是由_________ 个六元环构成的六体的笼状结构,其中有__________个碳原子为三个环共有。
(10分) 现有①苯;②甲苯;③氯苯;④苯酚;⑤乙烯;⑥乙醇。其中:
(1)能和金属钠反应放出氢气的有
(2)能和NaOH溶液反应的有
(3)常温下能和浓溴水反应的有
(4)用于制取TNT的是
(5)能使酸性KMnO4溶液褪色的是
(本题有3小题)(共10分)
I.下列两个图示,A所表示的是--------------热反应,B所表示的是--------------热反应。
AB
II.在氢气与氯气反应生成氯化氢气体的反应中,若断裂1mol H - H键要吸收436KJ的能量,断裂1mol Cl- Cl键要吸收243KJ的能量,断裂1molH - Cl键要吸收432KJ的能量,则表示1mol 氢气在氯气中充分燃烧的热化学方程式是。
III.如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
(1)实验中观察到的现象是试管中,烧杯中析出晶体。
(2)写出试管中反应的离子反应方程式,
(3)由此推知,MgCl2溶液和H2的总能量填(“大于”“小于”或“等于”)镁片和盐酸的总能量
(共14分)下表是元素周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
 |
ⅠA |
0 |
||||||
| 1 |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
||
| 2 |
D |
E |
G |
I |
||||
| 3 |
A |
B |
C |
F |
H |
(1)表中元素,化学性质最不活泼的是,氧化性最强的单质是,还原性最强的单质是;
(2)最高价氧化物的水化物碱性最强的是,酸性最强的是,呈两性的是;
(3)要证明A、B、C的金属活泼性,可以用什么实验来证明,试举一例
实验操作;
实验现象:;
有关化学方程式:
(4)G与H的气态氢化物稳定性>,说明相应单质的非金属性>。
已知A~O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应放出氢气。D是一种离子化合物,其阴阳离子的个数之比为2:3,且能与足量的水反应得到两种碱。C为淡黄色固体化合物,物质O能与G的水溶液反应生成蓝色沉淀。
(1)组成H单质的元素位于周期表第周期,第族;
(2)化合物D的化学式为;
(3)物质F的水溶液与G的水溶液在常温下反应的离子方程式为:;
(4)物质C与等物质的量的KHSO3溶液反应的离子方程式为:;
(5)物质N的浓溶液与Cu反应的化学方程式:。