将含有2.05 g某高价含氧酸的钙盐的溶液A与含1.20 g碳酸盐的溶液B混合,恰好完全反应,生成1.25 g白色沉淀C。将滤去沉淀C的滤液蒸发,得到白色固体D,继续加热D时,D分解只得两种气态物质的混合物,在0 ℃、1×105 Pa下,体积变为0.56 L,并得到0.90 g液态水,另一种气态物质为气态氧化物R2O。试回答:
(1)白色沉淀C的物质的量为________mol。
(2)A的摩尔质量为__________,B的摩尔质量为__________。
(3)R2O与H2O的物质的量之比为__________,生成D的质量为________,D的摩尔质量为________,R2O的相对分子质量为________,R2O的化学式是____________。
(4)写出A和B混合的化学方程式_____________________________________________。
12分)许多尾气中含有NOX、SO2等造成空气污染的气体。根据要求回答下列问题:
(1)已知:NO2(g)+CO (g)  CO2 (g) +NO (g)。
CO2 (g) +NO (g)。
①密闭容器中发生该反应时,c(CO2)随温度(T)变化曲线如图所示。据此判断,升高温度,该反应的平衡常数(选填“增大”、“减小”“不变”)。
②NO对臭氧层破坏会起催化作用,其主要过程为:Ⅰ.O3 O+O2
O+O2
Ⅱ.NO+O3 →NO2+O2
Ⅲ.。(请写出“Ⅲ”中的化学反应方程式。)
(2)将CO2和H2合成二甲醚(CH3OCH3)已取得了较大的进展,其化学反应为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①1g二甲醚气体完全燃烧生成两种气态氧化物,放出能量q kJ,请写出该反应的热化学方程式;
②二甲醚可以作为燃料电池的燃料,若用硫酸做电池中的电解质溶液,请写出该燃料电池工作时负极电极反应式。
(3)室温条件下,用0.10mol·L-1盐酸分别滴定20.00mL浓度均为0.10mol·L-1的NaOH溶液和氨水,下图是滴定其中一种溶液时,所得混合液的pH与加入盐酸体积的关系曲线图。
①该曲线表示滴定(填“NaOH”或“氨水”)的过程;
②当向20.00mLNaOH溶液中加入v mL盐酸时,所得混合溶液pH=12,则v =。(保留2位小数)
A、B、C、D均为中学化学常见的纯净物,A是单质,它们有如图反应关系。根据要求回答问题:
(1)若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染。写出D转化成C的反应化学方程式。
(2)若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化。在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H 1、△H 2、△H 3,则它们之间的关系为_______________________(用含△H 1、△H 2、△H 3的代数式表示)
(3)若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,请写出工业上用D制备A的化学方程式__________________________。
(4)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种气态非金属单质。请简要说明实验室保存D溶液的方法。
X、Y、Z、R、W为五种原子序数依次增大的短周期元素。
已知:①X元素的原子半径是所有原子中最小的;
②Y元素的原子最外层电子数是最内层电子数的2倍。
③Y与R可以形成YR与YR2两种化合物,其中一种是造成温室效应的物质之一。
④W与R能形成原子个数之比为2:1和1:1的离子化合物甲和乙。
根据要求回答问题:
(1)R在周期表中的位置是_______________;甲的电子式是___________。
(2)元素Y、R的最简单氢化物的稳定性由大到小顺序为(填化学式)。
(3)X2R与乙反应的化学方程式是__________________。
(4)元素Y、R、W形成的化合物的水溶液常用作清洗厨房的油污,其原理是(用离子方程式表示)。欲使0.1mol·L-1该溶液中浓度最大的阳离子与浓度最大的阴离子浓度之比=2,可以加入的物质是(填一种)。
化学链燃烧是将燃料与载氧体再被空气氧化再生,以实现较低温度下燃烧的过程。该过程具有无火焰、低污染、高效率的特点。
(1)用煤作燃料时,需要先用H2O或CO2将煤转化为燃料气。950℃时,焦炭被H2O氧化后产物的体积分数如图所示、其中H2含量较多的原因是、(用化学方程式表示)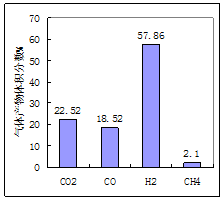
(2)燃料反应的气体产物主要是H2O和CO2通过(填操作名称)分离出水,并回收CO2。
(3)CaSO4是一种载体,请写出CaSO4与H2反应的化学方程式;CO还原载体CaSO4的主要反应是①,副反应是②
①CaSO4( s)+4CO(g)=CaS(s)+4CO2(g) △H=-175.6 kJ.mol-1
②CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g) △H=+218.4 kJ.mol-
右图是CO与CaSO4在900℃反应后,固体的物质的量分数与n(CaSO4)/n(CO)的关系图。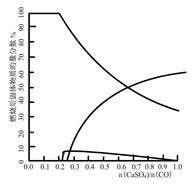
当n(CaSO4)/n(CO)>0.25时,产生对环境影响的气体是,你的理由。
硼及其化合物在工业生产中应用广泛。用硼镁矿(主要成分Mg2B2O5.H2O)采用碳铵法生产硼酸主要流程如下:

(1)硼镁矿焙烧时需要粉碎,其目的是。硼镁矿焙烧过程中只生成两种物质,写出化学方程式。
(2)硼酸溶解度如下所示,从NH4H2BO3溶液获得硼酸晶体蒸发浓缩、冷去结晶、过滤、洗涤、干燥获得硼酸晶体。洗涤过程中需要用(填“冷水”或“热水”),你的理由是。
(3)测得硼酸晶体纯度的试验方法是,取0.5000g样品与锥形瓶中,加甘油和刚冷却的废水,微热使样品溶解,迅速冷却至室温,加酚酞指示剂,用NaOH标准溶液滴定至15.80ml时,溶液恰好显粉红色且半分钟不褪色。
已知:每1.00mlNaOH滴定液相当于30.92mg的H3BO3
①迅速冷却锥形瓶中溶液的方法是;
②滴定实验中加入甘油的目的;
③测该样品中H3BO3的质量分数为;