氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式为________。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮做氧化剂,反应产物是氮气和水。由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,则推进剂中联氨的质量________。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为6NO+ 4NH3=5N2+6H2O 6NO2+ 8NH3=7N2+12H2O。NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g/cm3。则①该混合气体中NO与NO2的体积比为________,②吸收后氨水的物质的量浓度________(答案保留1位小数)。
某镇有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含SO2的废气和含H2SO4的酸性废水。当地的其他工厂和居民均用煤炭作燃料。只要下雨就下酸雨,对该镇环境造成极大破坏。
(1)分析该镇下酸雨的原因:
(2)举一例说明酸雨对环境造成的危害:
(3)该镇某中学环保小组提出了治理酸雨的下列措施,你认为其中不妥的是
| A.将硫酸厂搬离该镇 | B.建议环保部门限令整改 |
| C.将硫酸厂排出的废气中的SO2处理后排放 | D.工厂和居民改用较清洁的燃料 |
(4)可用熟石灰来处理硫酸厂排出的酸性废水,处理原理的化学方程式是
(5)浓硫酸弄到手上后应立即用水冲洗,然后涂上碳酸氢钠。若是稀硫酸弄到手上,
(填“需要”或“不需要”)这样做,理由是
小艾同学在妈妈买回的某食品包装内发现有一包白色颗粒状固体A的小纸袋,上面写着“生石灰干燥剂,请勿食用”。小艾同学随手将小纸袋放在窗台上,过一段时间后发现纸袋内的白色颗粒粘在一起成为块状固体B。小艾同学请你和同学们一起对块状固体B进行探究。
(1)猜想一:块状固体B中除氧化钙外,还可能有(写两种);
(2)猜想二:块状固体B溶于水可能有现象(填“放热”或“吸热”)。
(3)取块状固体B加入盛有一定量水的试管内,振荡、静置、过滤,得到少量白色固体C。就白色固体C同学们展开了热烈讨价,一起猜想。
小艾同学认为白色固体C可能是氢氧化钙,小聪同学认为白色固体C可能是碳酸钙;你认为白色固体C还可能是(任写一种)。
世界是物质的,物质是由各种化学元素组成的,请你写出下列物质的化学式:
(1)“西气东输”工程中输送的气体是;
(2)水银不是银,是一种金属的俗称,这种金属是;
(3)既可用来消毒杀菌,又可用来改良酸性土壤的碱是;
(4)氧元素的质量分数最多的氧化物是。
某校实验小组的同学用实验的方法区别稀盐酸和稀硫酸钠溶液(记作M、N),请你一同参与。
⑴甲组同学向M、N中分别加入少量的铁粉,观察到M中产生大量无色气泡,则M中发生反应的化学方程式为。
⑵乙组同学向M、N中分别滴加Na2CO3溶液,发现M也有无色气泡产生,N没有气泡产生,则M中发生反应的化学反应方程式为。
⑶丙组同学向M、N中分别加入滴加BaCl2溶液,N中出现的现象是。
⑷丁组同学用了下列试剂中的一种也将M、N区别开来,这种试剂是(填序号)
①酚酞试液②硫酸铜溶液③氯化钠溶液④pH试纸
A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产物已略去):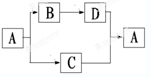
(1)若A是一种白色难溶于水的钙盐,由三种元素组成,C 是大气循环循环中的一种重要物质.则B的化学式是 ,C和D反应生成A的化学方程式是 。
(2)若A是无色液体,D是一种黑色固体.则C的化学式是 ,由B生成D的化学方程式为 。
(3)若A是碳酸氢钠,且已知碳酸氢钠受热可分解为碳酸钠、二氧化碳和水.写出过量的气体C与D溶液反应生成A的化学方程式 。