对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
| 实验内容 |
实验现象 |
分析与结论 |
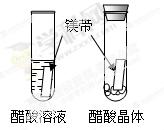 |
醋酸晶体试管内 (1),醋酸溶液试管中镁带表面冒气泡。 |
酸的很多反应通常在水溶液中才能完成。 |
用玻璃棒蘸硫酸在白纸上写字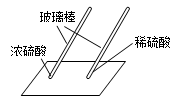 |
(2)(填“浓”或“稀”)硫酸使白纸炭化。 |
即使是同种酸,由于(3) 不同,它们的性质不完全相同。 |
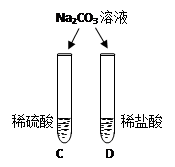 |
两试管中均产生(4) |
不同的酸具有相似的性质,这是因为酸的组成中都含有 (5)(填元素符号)。 |
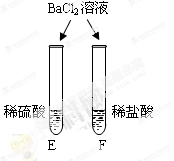 |
E试管中产生 (6) , F试管中无明显现象。 |
不同的酸根会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸。 |
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请分析上述现象并回答:
Ⅰ.废液缸中产生气体的化学方程式为 (7) 。
Ⅱ. 废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有 (8) (填化学式)。
(8分)某兴趣小组发现一袋腌制松花蛋的泥料,配料表上的成分是氧化钙、纯碱和食盐。他们要探究在腌制松花蛋过程中都有哪些物质对鸭蛋起作用。于是取少量泥料在水中溶解,充分搅拌后过滤,取滤液探究其成分。
【猜想与假设】他们都认为滤液中一定有NaCl和NaOH。生成氢氧化钠的化学方程式为。对其他成分他们分别做出了如下猜想:
小亮猜想:还可能有Na2CO3
小强猜想:还可能有Ca(OH)2和Na2CO3
你认为谁的猜想是错误的,理由是。你还能做出的猜想是:还可能有。
【活动与探究】小亮取一定量的滤液于试管中,向其中滴加了几滴稀盐酸,振荡,没有气泡,于是他得出结论:没有Na2CO3。
请你选择CO2以外的物质,设计一个实验方案验证你的猜想。
| 实验步骤 |
现象及相应结论 |
【反思】小强认为小亮的结论不严密,理由是。
金属材料被广泛的应用于我们的生活中,不仅是因为其物理性能优良,还与它们的化学性质密切相关。下面是小明同学设计测定金属铁、铜和镁的活动性的探究实验过程和实验记录,请你一起探究。
【实验目的】 测定金属铁、铜和镁的活动性强弱
【所用试剂】 稀硫酸、硝酸银溶液、光亮的薄铁片、薄铜片、薄镁片
【实验过程】
步骤Ⅰ 将铁片、铜片、镁片分别在空气中点燃片刻,观察燃烧现象;
步骤Ⅱ 将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的稀硫酸的试管中;
步骤Ⅲ 将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的硝酸银溶液的试管中。
【实验记录】用“√”表示能观察到实验现象,用“—”表示观察不到实验现象(见下表)。
⑴通过步骤Ⅰ可以得出三种金属中镁的金属活动性最强,判断依据是
⑵运用“控制变量法”设计实验方案是化学研究的重要方法。步骤Ⅱ和步骤Ⅲ中,需要控制的实验条件除了金属的体积、溶液的体积、溶质质量分数以外,还需要控制的条件是。写出镁和稀硫酸反应的化学方程式,此反应属于。
【实验结论】金属铁、铜和镁的活动性由强到弱的顺序是(用元素符号表示)
【反思交流】 若利用上述试剂制取氢气,小明认为应该选择金属铁和稀硫酸反应,而不选择金属镁和稀硫酸反应,他的理由是。
(12分)某研究性学习小组的同学在用硫酸溶液处理废锌片时发现产生的气体具有刺激性气味,这种现象引起同学们的思考和研究。
【提出猜想】对生成的气体进行猜想:
猜想1:可能是H2 ;
猜想2:可能是SO2;
猜想3:可能是。
【查阅资料】SO2易溶于水,能与NaOH溶液反应生成Na2SO3。
【实验方案】研究性学习小组的同学设计了下图所示的装置进行探究(夹持仪器已
省略,假设装置中的反应都进行完全)。
【问题讨论】
(1)如果装置A没有明显实验现象,装置C的现象为,则猜想成立。
(2)如果装置A的现象为,装置C没有明显实验现象,则猜想成立。
(3)猜想3成立的实验现象是。
(4)装置B中浓硫酸的作用是。
【思维拓展】
(1)实验室中可以用氢氧化钠溶液吸收二氧化硫,反应的化学方程式是。
(2)小组内一同学又设计了判断SO2与NaOH溶液能否发生反应的装置(如下图),实验时发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论,其他同学认为这一结论不严谨,理由是__________________________________________。要得到科学严谨的结论,仍利用该装置,需做的对比实验。
我国道教发源地山东威海圣经山摩崖石刻,为国内罕见的大型道教石刻,可称为瑰宝。圣经山摩崖石刻的材质是大理石,主要成分是碳酸钙,现在字迹已模糊不清。摩崖石刻被腐蚀,是否是酸雨所致?试回答下列问题:
(1)酸雨的成因:即使大气没有受到污染,正常的雨水或河水也呈微弱酸性(
在5.6~7之间),原因是。酸雨的酸性比正常雨水强,是因为雨水吸收了被污染的大气中的等有害气体。大气中这些有害气体主要来自于。
(2)定量实验探究:
查阅资料及定性实验表明:
(1)醋酸和酸雨的酸性程度差不多, 在5.6~3之间;
(2)酸雨(醋酸)确实能加重大理石腐蚀的程度;
(3)定性实验显示:将大理石放入
=3的醋酸溶液中,短时间内几乎看不出有气泡产生。
现提供下列仪器和试剂:
仪器:烧杯、托盘天平、镊子、量筒、胶头滴管。
药品:
=6.5的普通雨水、
=3醋酸溶液、大理石薄片。
请你设计一个"定量实验方案",证明摩崖石刻被腐蚀,主要与酸雨有关,与普通雨水无关。
| 实验内容及步骤 |
应得到的实验结果 |
(3)下列与保护摩崖石刻有关的说法中,你同意的是( )
A.了解哪种人类活动最容易引起酸雨
B.引起酸雨原因的结论应建立在科学研究的基础上
C.保护摩崖石刻要建立在有关损坏原因的科学证据的基础上
D.要从根本上预防酸雨的危害,应禁止工厂和汽车排放气体
E.要减少酸雨的危害,应研究和推广减少有害气体排放的技术
F.要从根本上保护摩崖石刻,主要应研究修复被酸雨损伤的摩崖石刻的方法与技术
(9分) 在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如下图所示的实验。
⑴写出试管②中碳酸钠与氢氧化钙反应的化学方程式:
。
⑵实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究。
【提出问题】滤液中除水外还含有哪些物质?
【猜想】 小红认为:只含氢氧化钠;
小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:可能含有氢氧化钠和碳酸钠;
你认为还可能是(写一种猜想)。
【讨论】你认为小红、小明、小亮三位同学中谁的猜想不合理,请说明理由。
【实验设计】设计一个简单的实验证明你的猜想正确。
| 实验步骤 |
实验现象 |
实验结论 |
| 取样于试管中, |
你的猜想正确 |
【实验分析】小亮同学针对自己的猜想进行了如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 取样于试管中,滴入几滴稀盐酸 |
没有气泡产生 |
自己的猜想不成立 |
你认为小亮同学对实验结果判断是否正确?请说明理由。
【反思拓展】
①在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑
;
②通过以上探究,你认为应怎样处理上述实验后的废液才能倒入下水
道?。