(2013吉林)2013年中央电视台举办的“3.15”晚会,曝出某品牌金饰品掺假的事件,引起同学们的好奇。某化学兴趣小组在老师的帮助下,对几种常见金属饰品所含的金属进行了相关的探究活动。
【提出问题】
(1)怎样鉴别真假黄金?
(2)怎样确定钯的金属活动性?
【查阅资料】
(1)假黄金通常是黄铜(Cu-Zn合金);
(2)钯(Pd)呈银白色,有金属光泽,可用作饰品。
【实验药品】钯、铂(Pt)、稀盐酸、硝酸银溶液和氯化钯(PdCl2)溶液
【实验探究】
(1)鉴别黄金样品的真假
取黄金样品于试管中,滴加稀盐酸后,观察到黄金样品表面有气泡产生,该气体是 ,说明此样品为 (选填“真”或“假”)黄金。
(2)探究钯的金属活动性
依据生活经验,同学们猜想钯的活动性可能与银和铂相近,于是他们利用上述药品进行如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 把钯浸入硝酸银溶液中 |
. |
钯的活动性比银弱 |
| 把铂浸入氯化钯溶液中 |
无明显现象 |
钯的活动性比铂 |
初步得出结论:钯、银、铂的金属活动性由强到弱的顺序为 。
【废液处理】
(1)转化成沉淀。小组同学将所有液体倒入废液缸中,出现白色沉淀。写出产生该现象的化学方程式
(写出一个即可);
(2)通过科学合理的方法进一步回收金属钯。
实验室常用石灰石和稀盐酸制取二氧化碳。
探究一气体发生装置的选择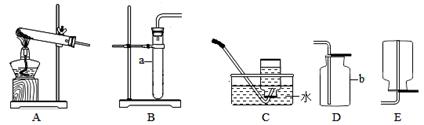
(1)写出图中带标号仪器的名称:a;b。
(2)实验室制取二氧化碳气体,发生和收集装置分别选用和(填字母),
检验集满的方法是。
探究二药品的选择
小明对三组药品进行了研究,实验记录如下:
| 组别 |
药品 |
实验现象 |
| ① |
块状石灰石和稀盐酸 |
产生气泡速率适中 |
| ② |
块状石灰石和稀硫酸 |
产生气泡速率缓慢并逐渐停止 |
| ③ |
粉末状石灰石和稀盐酸 |
产生气泡速率很快 |
对照实验①③,是探究对产生二氧化碳速率的影响;
对照实验,是探究不同的酸对产生二氧化碳速率的影响;
小明选择第①组药品来制取二氧化碳,该组反应的化学方程式为;
探究三生成二氧化碳量的测定
实验室常通过下列两种途径测量生成二氧化碳的量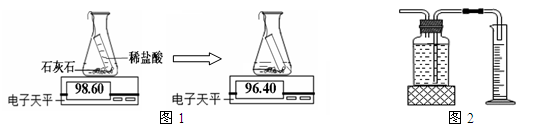
途径一(如图1):由图可知产生二氧化碳的质量为g。
途径二(如图2):通过排水法测得生成二氧化碳的体积。
由上两种途径比较,你认为哪种途径实验结果更为准确,理由是 。
小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签已破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认。老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或碳酸钠中的一种。
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是。
(2)小亮取少量样品于一只洁净的试管中,向其中滴加无色酚酞溶液后,溶液变为红色,该溶液不可能
是(填写化学式)。
(3)为了确定该溶液的成分,小亮同学继续进行下列实验,请一起参与,并填写下列实验报告。
[设计实验]方案甲:选择氯化钙溶液来确定该溶液的成份;
方案乙:选择稀盐酸来确定该溶液的成份。
[进行实验]请你从方案甲和方案乙中选择一种方案进行实验。
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量溶液于试管中,滴加。 |
该溶液是碳酸钠溶液。 有关反应的化学方程式为: 。 |
[实验反思]有同学认为还可以用一种常见的碱溶液来确定,那么它是溶液(填化学式)。
某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计了如下实验方案:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定。
(1)仪器①的名称是。如果该实验选择图(一)装置来制取氧气,则所反应的化学方程式为。其中二氧化锰的起到作用。
(2)用图(二)装置可收集和干燥氧气:若烧瓶充满水来收集氧气,气体应从 (“a”或“b”)端通入。
(3)图(三)是用干燥纯净的O2与样品反应来测定二氧化锰质量分数的装置,装置③中装有碱石灰,其作用是____________________________________________________。
(4)为验证图(三)中装置②已将CO2吸收完全,可在装置②与③之间加入图(四)装置进行证明,则图(四)装置中加入的试剂为__________(填字母)。
A. NaOH溶液B. 澄清石灰水C. 浓硫酸
某兴趣小组探究分子的特性时做了以下三组实验。
【实验一】已知:碱性溶液能使酚酞试液变红,而氨水呈碱性,打开盛浓氨水的试剂瓶时能够闻到强烈刺激性气味。请回答实验中的有关问题:
(1)甲同学用小烧杯取约40mL蒸馏水,向其中滴入5~6滴酚酞溶液,搅拌均匀,溶液的颜色无明显变化
(2)如图1所示,取上述溶液置于试管中,向其中慢慢滴加氨水,观察溶液颜色的变化是,通过上述实验,得出的结论是
(3)将烧杯中的酚酞溶液分别倒入A、B两个小烧杯中,另取一个烧杯C,向其中加入约5mL浓氨水.用一个大烧杯罩住A、C两个小烧杯,烧杯B置于大烧杯外(如图2所示).观察几分钟,烧杯A、B发生现象分别是
,这一现象说明B烧杯的作用是 。
【实验二】乙同学将实验一进行改进(如图3所示)后进行有关分子性质的探究实验:在试管中的滤纸条上相间滴有无色酚酞溶液,试管口塞上一团蘸有浓氨水的棉花,试管中看到的现象是此现象说明了:。
如下图所示,某同学在玻璃管两端分别放入蘸有浓氨水和浓盐酸的棉花团,发现C处产生的白烟较多.
查阅相关资料可知:已知①浓氨水能挥发出氨气,浓盐酸能挥发出氯化氢气体,二者接触反应会产生白烟(即氯化铵固体);②由于分子质量小,所以化学上引入了分子的相对质量来表示分子的质量,即相对分子质量。③氨气分子的相对质量是17,氯化氢分子的相对质量是36.5。由此可知,分子的运动速率与相对分子质量的关系是。
【实验三】丙同学设计实验如图4所示,在一个玻璃杯中放入约50ml水,向水中放入一大块糖块,在容器外壁沿液面画一条水平线,当糖块消失后,液面比水平线(“高”“低”“相平”),这一现象说明了,同时还可以说明。
(10分)下图中的甲、乙两套装置都可以用来探究可燃物燃烧的条件。
(1)某同学用甲图所示的装置进行探究实验,观察到的现象是 该反应属于 (填“化合”或“分解”)反应。
(2)另一同学用乙图所示的装置进行了探究实验,得出了以下四个实验事实:
①不通空气,热水中的白磷不能燃烧
②不通空气,冷水中的白磷不能燃烧
③通空气,热水中的白磷能燃烧
④通空气,冷水中的白磷不能燃烧
比较 (填序号)两个实验可以得出“可燃物燃烧需要与空气接触”的结论;比较 (填序号)两个实验可以得出“可燃物燃烧需要达到一定温度(着火点)”的结论。
(3)甲图与乙图所示实验相比, (填“甲”或“乙”)更体现了化学实验的绿色化追求。
(4)同学们查阅资料获取到这样一条信息:“点燃的镁带可以在二氧化碳气体中继续剧烈燃烧,生成碳和氧化镁”。请写出该反应的化学方程式:,你对燃烧或灭火有什么新的认识