实验室常用石灰石和稀盐酸制取二氧化碳。
探究一 气体发生装置的选择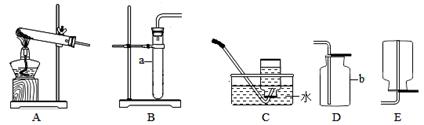
(1)写出图中带标号仪器的名称:a ;b 。
(2)实验室制取二氧化碳气体,发生和收集装置分别选用 和 (填字母),
检验集满的方法是 。
探究二 药品的选择
小明对三组药品进行了研究,实验记录如下:
| 组别 |
药 品 |
实验现象 |
| ① |
块状石灰石和稀盐酸 |
产生气泡速率适中 |
| ② |
块状石灰石和稀硫酸 |
产生气泡速率缓慢并逐渐停止 |
| ③ |
粉末状石灰石和稀盐酸 |
产生气泡速率很快 |
对照实验①③,是探究 对产生二氧化碳速率的影响;
对照实验 ,是探究不同的酸对产生二氧化碳速率的影响;
小明选择第①组药品来制取二氧化碳,该组反应的化学方程式为;
探究三 生成二氧化碳量的测定
实验室常通过下列两种途径测量生成二氧化碳的量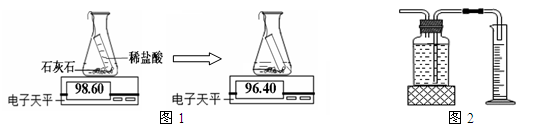
途径一(如图1):由图可知产生二氧化碳的质量为 g。
途径二(如图2):通过排水法测得生成二氧化碳的体积。
由上两种途径比较,你认为哪种途径实验结果更为准确,理由是 。
某研究小组在学习氧气的化学性质时发现:铁丝在氧气中燃烧没有火焰,而蜡烛在氧气中燃烧却有明亮的火焰。该小组同学进行了如下探究。
(1)写出铁丝在氧气中燃烧的文字表达式:。
(2)探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由(填“固态”或“气态”)物质燃烧形成的。
(3)探究二:物质燃烧产生火焰的根本原因是什么?
【查阅资料】
| 物质 |
熔点╱℃ |
沸点╱℃ |
燃烧时温度╱℃ |
| 石蜡 |
50∽70 |
300∽550 |
约600 |
| 铁 |
1535 |
2750 |
约1800 |
| 钠 |
97.8 |
883 |
约1400 |
由上表可知:物质燃烧能否产生火焰与其(填“熔点”或“沸点”)和燃烧时温度有关。通过上表中石蜡、铁的数据对比,你认为物质燃烧时,什么情况下能产生火焰。由此推测:钠在燃烧时,(填“有”或“没有”)火焰产生。
(4)根据硫在空气或氧气中燃烧的实验事实,请你推测硫沸点硫燃烧时的温度(填“>”或“<”或“=”)
化学是以实验为基础的自然科学,通过实验现象的观察和分析得到结论。结合下列实验回答问题。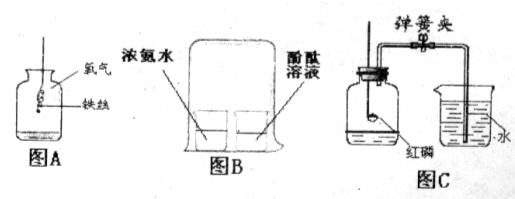
图A所示实验集气瓶中的现象是:铁丝在氧气中剧烈燃烧,__________,放出大量的热,有黑色固体生成,该反应的符号表达式是_____________。
图B所示实验可观察到酚酞溶液由________色变为__________色,该实验中没有涉及的性质是_________(填字母)。
A.氨分子是不断运动的 B.氨分子有一定质量 C.浓氨水具有挥发性
图C所示实验用于测定空气中氧气的含量。红磷在空气中燃烧的符号表达式是______________,关于该实验的下列说法中正确的是__________(填字母)。
A.实验时红磷一定要足量B.点燃红磷前先用弹簧夹夹紧乳胶管
C.红磷熄灭后立刻打开弹簧夹 D.最终进入瓶中水的体积约为氧气的体积
E. 该实验必须检查装置的气密性
乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体。
【查阅资料】电石主要成分为碳化钙(CaC2),它没有可燃性。
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:;猜想三:Ca(OH)2。
他的依据是。
【交流反思】经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是:
。
【进行实验】
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到,证明猜想二不成立。
(二)取少量白色固体加入到水中,取上层清液,通入,有白色浑浊出现,证明猜想三成立。该反应的化学方程式为:。
结论:白色固体是Ca(OH)2。
【拓展应用】某市一辆满载电石的货车遇大雨引发熊熊大火,其中的可燃物是________,且该反应放出大量热,使可燃物达到_______________。
【交流反思】通过上述实验可知,电石在保存和运输时的注意事项__________________
小明、小华、小林和小军四位位同学利用下图所示装置在实验室制取O2和CO2,并对它们的有关性质进行研究,请回答下列问题。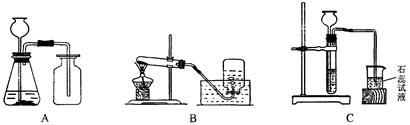
(1)小明同学用KMnO4固体制取O2,应选用上图中的装置(填编号),该反应的化学方程式为;该反应的基本反应类型__________当O2收集满并取出集气瓶后,停止该实验的正确操作方法是__________
(2)小华同学用浓HCl(具有挥发性)与大理石在C装置中反应,制取CO2并检验其有关性质,观察到烧杯中紫色石蕊试液变红,对这一现象的解释不合理是(填序号)。
a.产生的CO2直接使石蕊试液变红
b.产生的CO2与H2O反应生成H2CO3,使石蕊试液变红
c.挥发出的氯化氢溶于水,使石蕊试液变红
(3)小林同学用A装置制取氢气,他需要做的改动是__________________,点燃氢气前一定要_______________________。写出氢气燃烧的化学方程式__________________。
(4)小军也用A装置制取氧气,分别倒入适量的6%、15%的双氧水,再加入等量的MnO2,各收集一集气瓶气体,发现浓度大的先收集满。由此可以得出,其它条件相同时,化学反应速率与反应浓度的关系是__________________。
化学就在我们身边
(1)萌萌是个爱劳动的孩子,平时自己的衣物总是自己清洗,她发现用湿手取少量洗衣粉时感觉到手发烫,原因是洗衣粉溶于水(填“放热”或“吸热“)。生活用水在净化过程中常用吸附色素和异味,一般可以通过的方法降低水的硬度。
(2)我们在实验室通常用酒精灯给物质加热,其燃烧的燃料是乙醇,俗名酒精,酒精是一种清洁能源,它属于(选填“纯净物” 或“ 混合物)”,是(选填“可再生”或“不可再生”)能源。酒精燃烧的化学方程式为。
(3)PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物。它的直径还不到人的头发丝粗细的1/20,与较粗的大气颗粒物相比,PM2.5粒径小,富含大量的有毒、有害物质且在大气中的停留时间长、输送距离远,因而对人体健康和大气环境质量的影响更大,易引发包括哮喘、支气管炎和心血管病等方面的疾病.抽空多去野(如森林或海边)外走一走,那里的PM2.5值很低.
①PM2.5其实就是我国计入空气首要污染物的(填字母序号);
| A.氮氧化物 | B.二氧化硫 | C.一氧化碳 | D.可吸入颗粒物 |
②今年的11月份至今,海安地区已出现多次灰霾天气,污染比较严重,据统计,冬季是灰霾日相对集中的季节,其原因是_________________________
③在日常生活中,可以减少PM2.5的一点有效措施有