金属冶炼与处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是________。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应:2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是________。当1 mol O2发生反应时,还原剂所失电子的物质的量为________mol。向CuSO4溶液中加入镁条时有气体生成,该气体是________。
(3)如图为电解精炼银的示意图,________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为__________________________。
(4)为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用是______________________________________________。
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应(均为可逆反应):
①CO(g)+ 2H2(g) = CH3OH(g)△H1=—90.1 kJ·mol-1
②CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g)△H2=—49.0 kJ·mol-1
水煤气变换反应③CO(g) + H2O (g)=CO2(g)+H2(g)△H3=—41.1 kJ·mol-1
二甲醚合成反应④2CH3OH(g)=CH3OCH3(g)+H2O(g)△H4=—24.5 kJ·mol-1
(1)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为。
(2)一定温度下,在恒容密闭容器中进行反应①,下列描述能说明反应到达平衡状态的是。
a.容器中气体平均相对分子质量保持不变
b.容器中气体密度保持不变
c.CH3OH(g)浓度保持不变
d.CH3OH(g)的消耗速率等于H2 (g)的消耗速率
(3)一定温度下,将8mol CH3OH(g)充入5L密闭容器中进行反应④,一段时间后到达平衡状态,反应过程中共放出49kJ热量,则CH3OH(g)的平衡转化率为,该温度下,平衡常数K=;该温度下,向容器中再充入2mol CH3OH(g),对再次达到的平衡状态的判断正确的是。
a.CH3OH(g)的平衡转化率减小
b.CH3OCH3 (g)的体积分数增大
c.H2O(g)浓度为0.5mol·L-1
d.容器中的压强变为原来的1.25倍
(4)二甲醚—氧气燃料电池具有启动快,效率高等优点,其能量密度高于甲醇燃料电池,若电解质为酸性,二甲醚—氧气燃料电池的负极反应为;消耗2.8L(标准状况)氧气时,理论上流经外电路的电子mol
(1)硫元素有多种化合价,可形成多种化合物。填写下表中的空白:
| 化合价 |
-2 |
-1 |
0 |
+2 |
+4 |
+6 |
+7 |
| 代表物的化学式 |
FeS2 |
S |
Na2S2O3 |
SO3或H2SO4或Na2SO4 |
Na2S2O8 |
(2)已知NaHSO3溶液显弱酸陛,请写出该溶液中存在的各种平衡反应的离子方程式:。
(3)请按照浓度由大到小的顺序排列Na2SO3溶液中的离子:。
Na2SO3溶液放置于空气中一段时间后,溶液的pH(填“增大”“减小”或“不变”)。(不考虑水的蒸发)原因是
。
(4)某同学设计如下实验流程探究Na2S2O3的化学性质。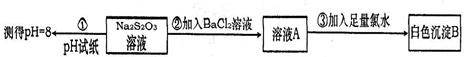
实验①可说明Na2S2O3能发生水解,实验②③说明Na2S2O3具有性。请你预测Na2S2O3还可能具有的化学性质(列举2条即可)、。
(15分)能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题。
I.已知:Fe2O3(s)+3C(石墨) =2Fe(s)+3CO(g)△H=akJ·mol-1
CO(g)+1/2O2(g)=CO2(g)△H=bkJ·mol-1
C(石墨)+O2(g)=CO2(g)△H=ckJ·mol-1
则反应:4Fe(s)+3O2(g)=2Fe2O3(s)的焓变△H=kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是(填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应。
负极:,
正极:。
(2)二氧化氯(ClO2)是一种高效安全的自来水消毒剂。ClO2是一种黄绿色气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2为原料制备ClO2流程如下:
已知:电解过程中发生的反应为:
NH4Cl+2HCl NCl3+3H2↑;假设NCl3中氮元素为+3价。
NCl3+3H2↑;假设NCl3中氮元素为+3价。
①写出电解时阴极的电极反应式。
②在阳极上放电的物质(或离子)是。
③除去ClO2中的NH3可选用的试剂是(填序号)
A.生石灰 B.碱石灰 C.浓H2SO4 D.水
④在生产过程中,每生成1mol ClO2,需消耗mol NCl3。
工业上制取三氧化硫反应的热化学方程式为:
2SO2(g)十O2(g)  2SO3(g)△H=-198kJ·mol-1
2SO3(g)△H=-198kJ·mol-1
(1)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是(填序号)。
A.每生成1mol SO3的同时生成0.5mol O2
B.容器中混合气体的密度不变
C.SO2、O2、SO3的物质的量之比为2:1:2
D.容器中气体总压强不变
(2)400℃,1.01×105Pa下,上述反应中n(SO3)和n(O2)随时间变化的关系如图所示。下列叙述正确的是(填序号)。
A.点a的正反应速率比点b的大
B.点c处反应达到平衡状态
C.点d和点e处的n(O2)相同
D.500℃,1.01×105Pa下,反应达到平衡时,n(SO3)比图中e点的值大
(3)已知该反应的K(400℃)=7200mol-1·L。在400℃时,容积为1.0L的密闭容器中充入0.05mol SO2(g)和0.03mol O2(g),反应一段时间后,有0.04mol SO3生成。此时,该反应(填“是”、“否”或“无法判断”)达到化学平衡状态,理由是。
某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,某研究性学习小组欲分析其成分,实验记录如下图所示。
(1)该矿石中含有(填化学式),请写出实验过程①中反应的离子方程式。
(2)将氧化物Ⅱ在熔融状态下电解,可以得到某金属单质。当阳极上收集到气体33.6L(已折算成标准状况)时,阴极上得到该金属g。
(3)试写出该金属与氧化物I反应的化学方程式;将该反应的产物加入到足量烧碱溶液中,请写出发生反应的离子方程式。
(4)经进一步分析该矿石中还含有微量的SrCO3(上述方案检测不出)。锶(Sr)为第五周期ⅡA族元素。下列叙述正确的是(填序号)。
①氯化锶(SrCl2)溶液显酸性
②SrSO4难溶于水
③工业上可以用电解SrCl2的水溶液制取金属锶(Sr)
④高纯六水氯化锶晶体(SrCl2·6H2O)必须在HCl氛围中加热才能得到SrCl2