某厂废水中含5.00×10-3 mol·L-1的Cr2O,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程: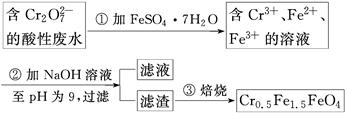
(1)第①步反应的离子方程式是________________________________________________。
(2)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有__________。
(3)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入________g FeSO4·7H2O。
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。
已知:
(1)写出反应类型:①,④。
(2)写出反应的条件⑤,⑦。
(3)写出C的结构简式,其中含氧官能团是,B的结构简式。
(4)下列可检验阿司匹林样品中混有水杨酸的试剂是。
(a)三氯化铁溶液 (b)碳酸氢钠溶液 (c)石蕊试液
(5)写出反应③的化学方程式。
(6)写出反应⑧的化学方程式。
有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下
| ② |
|||
| ⑦ |
⑧ |
②与⑧形成的液体化合物是常见的溶剂,则⑦元素在周期表中的位置是,②元素的氧化物的电子式是,②与⑧形成的化合物中存在的化学键是,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由弱到强的顺序是(用化学式表示)。⑦、⑧两种元素形成的阴离子半径大小顺序是(用离子符号填)。
(2)若甲、己、丙、丁、戊均为上述短周期元素中组成的单质或化合物,且甲、乙、丙为无色气体,戊为红棕色气体。根据下图所示转化关系推测:
①写出反应a的化学方程式:。
②写出戊与丁反应的化学方程式:。
(3)若下图中A、B、C、D、E分别是上述10种元素组成的单质或化合物。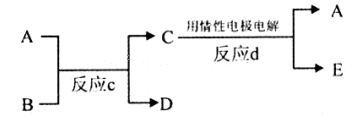
①若反应c是用A作电解池的阳极,电解B的水溶液,其中A是红色金属单质,E是具有黄绿色的气体。则反应d中阴极的电极反应式为:。
②若反应c是在高温下进行的。其中B是暗红色固体,当物质C是一种两性化合物,则反应c的化学方程式为。
已知2A2(g)+B2(g) 2C(g);△H=" -a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
2C(g);△H=" -a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
(1)比较a______b(填>、=、<)
(2)此反应的平衡常数表达式为______________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)。
(3)若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量ckJ,a、b、c之间满足何种关系__________________(用代数式表示)。
(4)能说明该反应已经达到平衡状态的是(填序号,有一个或多个选项符合题意,下同)。
a、v(C)=2v(B2) b、容器内气体压强保持不变
c、v逆(A2)=2v正(B2) d、容器内的气体密度保持不变
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
a、及时分离出C气体 b、适当升高温度
c、增大B2的浓度 d、选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2, 500℃时充分反应达平衡后,放出热量dkJ,则d_________b(填>、=、<)。
下图是常见物质间的反应关系,其中并且部分产物已被略去。常温下X为固体、B为液态,其余为气体。X受热分解生成A、B、C的物质的量相等。根据图中关系:
(1)推断化学式:X;A;B;D。
(2)写出C→E反应的化学方程式。
(3)写出X→A反应的离子方程式(OH-足量)。
(4)治疗心绞痛的药物三硝酸甘油酯,在人体体液中的酶的作用下,缓慢氧化自发释放出D分子,同时生成二氧化碳和水,写出该反应的化学方程式:。
有机物A的结构简式为 ,它可通过不同的化学反应分别制得B、C、D和E四种物质。
,它可通过不同的化学反应分别制得B、C、D和E四种物质。
请回答下列问题:
(1)在A~E五种物质中,互为同分异构体的是(填代号)。
(2)写出由A生成B的化学方程式和反应类型
,反应类型:。
(3)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是(填序号)。
(4)C能形成高聚物,该高聚物的结构简式为。
(5)写出D与NaOH溶液共热反应的化学方程式。