MgO、Al2O3、SiO2是中学化学中常见的氧化物。下列有关说法不正确的是( )
| A.MgO、Al2O3、SiO2分别是碱性氧化物、两性氧化物和酸性氧化物 |
| B.三者均可以采用单质在空气中燃烧或加热的方法制得 |
| C.MgO和Al2O3可以作为耐高温材料,SiO2可用于制作光导纤维 |
| D.分别电解熔融状态的MgO、Al2O3、SiO2可以制得Mg、Al、Si |
在一个固定容积的密闭容器中充入2 mol NO2,一定温度下建立如下平衡:2NO2(g)  N2O4(g),此时平衡混合气中NO2的体积分数为X%,若再充入1 mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为Y%,则X和Y的大小关系正确的是 ( )
N2O4(g),此时平衡混合气中NO2的体积分数为X%,若再充入1 mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为Y%,则X和Y的大小关系正确的是 ( )
| A.X>Y | B.X<Y | C.X=Y | D.不能确定 |
将一定量A、B装入容积为1 L的恒温密闭容器中,发生反应:2A(g)+bB(g)  cC(g),1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的
cC(g),1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的 ,重新达到平衡后,C的浓度为2.5 x mol·L-1,下列说法正确的是 ( )
,重新达到平衡后,C的浓度为2.5 x mol·L-1,下列说法正确的是 ( )
A.化学计量数的关系:b<c
B.容器的容积减小后,该反应的逆反应速率减小
C.原容器中用B的浓度变化表示该反应在1 min内的速率为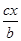 mol·(L·min)-1
mol·(L·min)-1
D.若保持温度和容器的容积不变,充入氦气(不参与反应),平衡不发生移动
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)  3C(g),若反应开始时充入2 mol A和1 mol B,达到平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是 ( )
3C(g),若反应开始时充入2 mol A和1 mol B,达到平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是 ( )
A.2 mol C
B.4 mol A、1 mol B
C.1 mol B和1 mol C
D.2 mol A、3 mol B和3 mol C
温度为T℃,压强为1.01×106 Pa条件下,某密闭容器中发生反应:A(g)+aB(?)  4C(g),达到化学平衡时测得c(A)=0.2 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.36 mol·L-1;若继续压缩容器,使压强增大到5.05×106 Pa,第三次达到平衡时,测得c(A)=1.1 mol·L-1。则下列有关说法不正确的是 ( )
4C(g),达到化学平衡时测得c(A)=0.2 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.36 mol·L-1;若继续压缩容器,使压强增大到5.05×106 Pa,第三次达到平衡时,测得c(A)=1.1 mol·L-1。则下列有关说法不正确的是 ( )
A.第二次平衡时B为气态
B. a>3
C.第一次平衡后增大压强平衡向左移动
D.第三次达到平衡时B为非气态
COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为:COCl2(g)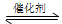 CO(g)+Cl2(g) ΔH<0,下列有关说法不正确的是 ( )
CO(g)+Cl2(g) ΔH<0,下列有关说法不正确的是 ( )
| A.在一定条件下,使用催化剂能加快反应速率 |
| B.当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变 |
| C.单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,反应达到平衡状态 |
| D.平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 |