A、B、C三种物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物已略去)。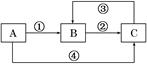
(1)若A是一种两性氧化物,B的水溶液呈酸性,请写出反应①和反应④(由A一步转化为B或C)的离子方程式:反应①______________________________________;
反应④_______________________________________________________。
(2)若反应①为置换反应,反应④为化合反应,C物质大量存在于海水中,是人体生理活动不可缺少的物质。工业上可以用C来制取A或B,请写出这两个反应的化学方程式:C→A________________________________________________________________________;
C→B_______________________________________________________________;
(3)若反应①②③均为化合反应,反应④为置换反应。当A为一种金属单质时,请写出反应②和③可能的离子方程式:②_____________________________________________;
③_____________________________________________________________________。
按以下步骤可从 合成
合成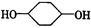 (部分试剂和反应条件已去).
(部分试剂和反应条件已去).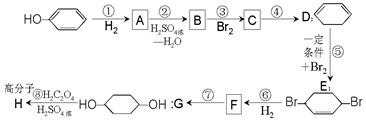
请回答下列问题:
(1)B、F的结构简式为:BF。
(2)反应①~⑦中属于消去反应的是(填代号)。
(3)根据反应 ,写出在同样条件下
,写出在同样条件下
CH2=CH—CH=CH2与等物质的量Br2发生加成反应的化学方程式:。
(4)写出第④步 的化学方程式(有机物写结构简式,注明反应条件).。
的化学方程式(有机物写结构简式,注明反应条件).。
(5)A—G这七种有机物分子中含有手性碳原子的是(填序号) 。
(6)核磁共振谱是测定有机物分子结构最有用的工具之一。在有机物分子中,不同位置的氢原子在质子核磁共振谱(PMR)中给出的峰值(信号)也不同,根据峰(信号)可以确定有机物分子中氢原子的种类和数目。例如:乙醛的PMR谱中有2个信号峰,其强度之比为3∶1。则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1∶1∶2的是。
A. B.
B.
C. D.
D.
某芳香族化合物A式量小于150,氢氧质量比为1∶8,完全燃烧后只生成CO2和H2O。取等质量的A分别与足量NaHCO3和Na反应,生成的气体在同温同压下的体积比为1∶1。工业常用A来合成药物B及医药中间体G,流程如下: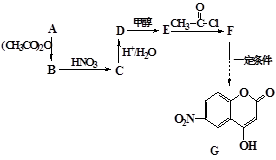
已知: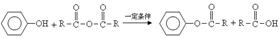

(1)写出A含有的官能团的名称,D的结构简式。
(2)D生成E的反应类型是。
(3)A合成B的同时,A自身之间也能发生缩聚反应,写出该缩聚反应的化学方程式。
(4)写出F与过量NaOH共热时反应的化学方程式。
(5)B有多种同分异构体,写出符合下列条件的一种物质的结构简式。
①只有一种官能团
②能发生银镜反应
③苯环上的一氯取代物只有二种
④核磁共振谱共有四组峰,个数比为3∶2∶2∶1。
(6)下列有关说法正确的是。
| A.可由A经一步反应获得D |
B.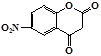 与G互为同分异构体 与G互为同分异构体 |
| C.G易水解,可用FeCl3溶液检验是否发生水解 |
| D.1molG一定能和5mol氢气反应 |
常见氨基酸中唯一不属于α-氨基酸的是脯氨酸。它的合成路线如下: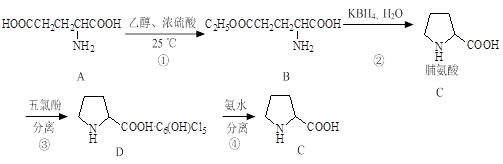
⑴反应①的类型为。
⑵写出一种不含手性碳原子的常见氨基酸的结构简式:。
⑶反应B→C可看作两步进行,其中间产物的分子式为C5H7O3N,且结构中含有五元环状结构。写出由B反应生成中间产物的化学方程式。
⑷合成路线中设计反应③、④的目的是。
某铝合金(硬铝)中含有铝、镁、铜等,为了测定该合金中铝的含量,有人设计了如下实验:(已知:硅不与盐酸和水反应)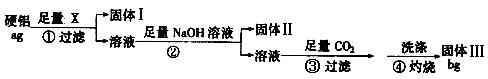
(1)若固体Ⅰ中含有铜,步骤①的试剂X应选择(填“NaOH溶液”“盐酸”“FeCl3溶液”);步骤②的操作是,得到固体Ⅱ反应的离子方程式为
(2)固体Ⅲ的化学式为步骤④反应的化学方程式为
(3)该铝合金中铝的质量分数是________________
(4)步骤④中的沉淀没有用蒸馏水洗涤时,会使测定结果(填“偏高”“偏低”“不影响”)
A、B、C、D、E五瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种。已知:①A与B反应有气体生成 ②B与C反应有沉淀生成 ③C与D反应有沉淀生成 ④D与E反应有沉淀生成 ⑤A与E反应有气体生成 ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
⑴在②和③的反应中,生成的沉淀物质的化学式(分子式)是__________。
⑵A是________,B是_______,C是_______,D是_______,E是________。
⑶A与E反应的离子方程式是____________________________________________。