甲酯除草醚(下图中E)是一种光合作用抑制剂,能被叶片吸收,但在植物体内传导速度较慢,它是芽前除草剂,主要用于大豆除草。某烃A合成E的路线如下:
A

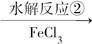


B
 C
C D
D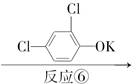

(1)写出A、C的结构简式:A________;C________。
(2)写出C中官能团的名称:________________。
(3)写出下列反应的化学方程式:
反应⑤______________________________________________________;
反应⑥__________________________________________________________,
反应类型是____________________________________________________。
(4)C的同分异构体有多种。写出核磁共振氢谱有四种不同化学环境的氢,且峰面积比为1∶2∶2∶2的四种有机物的结构简式: ________________________________________。
联合国气候变化大会2009年12月7日在丹麦首都哥本哈根拉开帷幕,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
工业上有一种方法是用CO2来生产燃料甲醇,298.15K时,CO2、H2、与CH3OH、H2O的平均能量与合成甲醇反应的活化能的曲线图如图1所示,据图回答问题:
(1)写出合成甲醇反应的热化学方程式;
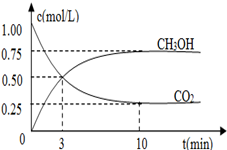
图1图2
(2)在图中曲线(填“a”或“b”)表示加入催化剂的能量变化曲线。
(3)在体积为l L的密闭容器中,充入lmolCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数为__________________,升高温度,K值(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 |
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O,则阴极反应式为:_______________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:__________________________。
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是
和 。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时也产生沉淀,向该沉淀中滴入稀HNO3,沉淀部分溶解。则:
①X为 (填字母)。
A.Br- B.SO C.CH3COO- D.HCO
C.CH3COO- D.HCO
②A中阴、阳离子个数比为
③B的水溶液中所有离子的浓度由大到小的顺序为
(用离子符号表示)。
④将0.02 mol的A与0.01 mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为 (精确到0.1 g)。
(3)将Cu投入装有足量D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D一定含有上述离子中的 (填离子符号),有关反应的离子方程式为。
(12分) 1 L某混合溶液中可能含有的离子如下表:
| 可能大量含有的阳离子 |
H+NH4+Al3+K+ |
| 可能大量含有的阴离子 |
Cl-Br-I‑ ClO‑ AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.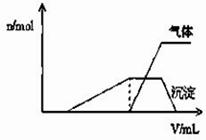
①则该溶液中确定含有的离子有;
②不能确定是否含有的阳离子有,
③要确定其存在可补充做的实验是;
④肯定不存在的阴离子有。
(2)经检测,该溶液中含有大量的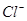 、
、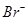 、
、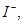 若向1 L该混合溶液中通入一定量的
若向1 L该混合溶液中通入一定量的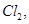 溶液中
溶液中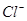 、
、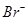 、
、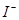 的物质的量与通入
的物质的量与通入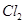 的体积(标准状况)的关系如下表所示,分析后回答下列问题:
的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
2.8 L |
5.6L |
11.2L |
| n(Cl-) |
1.25mol |
1.5mol |
2mol |
| n(Br-) |
1.5mol |
1.4mol |
0.9mol |
| n(I-) |
amol |
0 |
0 |
①当通入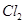 的体积为2.8 L时,溶液中发生反应的离子方程式为。
的体积为2.8 L时,溶液中发生反应的离子方程式为。
②原溶液中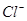 、
、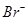 、
、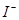 的物质的量浓度之比为。
的物质的量浓度之比为。
( 12分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为。
(2)上述反应中的氧化剂是,反应产生的气体可用吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为。若将该反应设计成一原电池,则NO2应该在(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。回答下列问题:
| m |
n |
||
| x |
y |
(1)元素x在周期表中的位置是___________周期,___________族,其单质可采用电解熔融___________的方法制备。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是___________,碱性最强的是___________(填化学式)。
(3)气体分子(mn)2的电子式为___________,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为___________________。