根据所学知识完成下列空白。
Ⅰ.(1)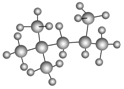 的名称(系统命名法)是 。
的名称(系统命名法)是 。
(2)(CH3)3CCH2CH(CH2CH3)CH(CH3)2的名称(系统命名法)是 。
(3)2,3-二甲基-4-乙基已烷 的结构简式______________________________。
Ⅱ.某盐的化学式为XmYn(m≠n),在水中能完全电离:XmYn=mXn++nYm-。将一定量的盐溶于足量水时:
(1)若测得溶液的pH为9,则该盐与水反应的离子方程式可能为: (用X或Y表示)。
(2)若X、Y为同周期的短周期元素,XmYn溶于水时,有白色沉淀产生,又有无色气体放出,则XmYn溶于水的化学方程式为:_________________________(用元素符号表示)。
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是
(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的。
a.NH3 b.CO2 c.NaOH d.HNO3
② 以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是
以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是
。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不有石墨作阳极的原因是。
(3)利用右图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于处。若X为锌,开关K置于M处,该电化学防护法称为。
某化学反应2A  B + D在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示。
B + D在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示。 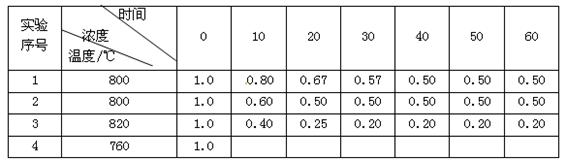
根据上述数据,回答下列问题:
(1)在实验1中,0~10min内的反应速率v(A)为 mol•L -1••min -1。
(2)与实验1相比,实验2的反应速率更 (填"快"或"慢"),其原因可能是 。
(3)根据实验1和实验3的数据分析升温对该反应的影响,写出两条结论:① ;
② 。
(4)实验4只改变温度,其它条件不变。请在答题卡的相应位置画出实验1和实验4的"浓度-时间"关系曲线。 
阻垢剂可防止工业用水过程中无机物沉积结构,经由下列反应路线可得知到E和R两种阻垢剂(部分反应条件略去)
(1)阻垢剂E的制备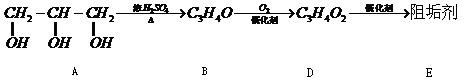
①A可由人类重要的营养物质
 水解制得(填“糖类”、“油脂”或“蛋白质”)
水解制得(填“糖类”、“油脂”或“蛋白质”)
②B与新制的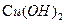 反应生成D,其化学方程式为。
反应生成D,其化学方程式为。
③D经加聚反应生成E,E的结构简式为。
(2)阻垢剂R的制备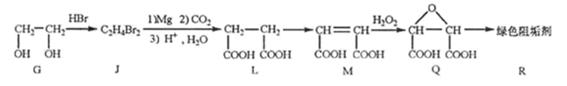
①G→J为取代反应,J的结构简式为。
②由L制备M的反应步骤依次为: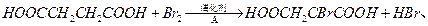
、(用化学方程式表示)。
③1mol Q的同分异构体T(碳链无支链)与足量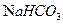 溶液作用产生2mol
溶液作用产生2mol 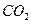 ,T的结构简式为(只写一种)。
,T的结构简式为(只写一种)。
(8分)化合物A含硫(每个分子只含一个硫原子)、氧以及一种或几种卤素。少量A与水反应完全水解但不发生氧化或还原反应,所有反应产物均可溶于水。将A配成水溶液稀释后分成几份,分别加入一系列0.1mol/L的试剂,现象如下:
①加入硝酸酸化的硝酸银,产生白色沉淀;
②加入氯化钡溶液,无沉淀产生;
③溶液经酸化后加入高锰酸钾溶液,紫色褪去,再加入硝酸钡溶液,产生白色沉淀。
⑴由①判断组成该化合物的元素中,肯定存在的卤素有,由②判断A与水反应后生成的溶液中肯定不存在的离子有 。由③判断A与水反应后生成的溶液中肯定存在的离子有 .
。由③判断A与水反应后生成的溶液中肯定存在的离子有 .
⑵要确定该化合物的分子式,称取11.90gA溶于水稀释至250.00mL,取25.00mL溶液加入足量的高锰酸钾和硝酸钡溶液,使沉淀完全,沉淀经洗涤、干燥后称重为2.33g。试确定A的化学式,写出计算推理过程。
氯碱工业是高耗能产业,为了提高原料的利用率,将电解的Y气体作为燃料电池燃料,为电解池供电;X气体作为钛的冶炼原料,在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中氯碱工业装置中的电极未标出,所用的离子交换膜只允许阳离于通过。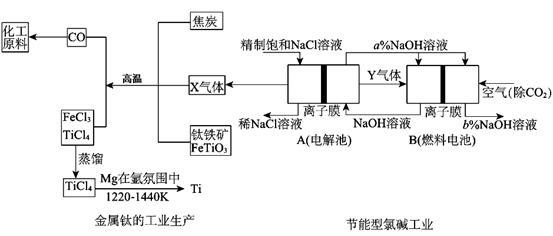
(1)①上图中的节能型氯碱工业部分,X、Y分别是、(填化学式),分析比较图示中NaOH质量分数a%与b%的大小;
②写出燃料电池B中正极上发生的电极反应:;
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式;
(3) TiCl4暴露在潮湿空气中冒白烟,白烟主要为白色的二氧化钛的水合物H2TiO3,写出该反应的化学方程式;
(4)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ·mol-1。
②1/2Ti(s)+ Cl2(g) =1/2TiCl4(1) △H=-385 kJ·mol-1。
则2Mg(s)+TiCl4(1)=2MgCl2(s)+Ti(s)的反应热为