A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球(作恒压容器处理)。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2  N2O4;△H<0)
N2O4;△H<0)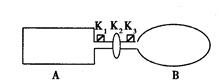
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA________VB (填“>”、“<”、“="”)" 。
若打开活塞K2,气球B将__________(填:变大、变小、不变)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将_________ (填增大或减小、不变);若通入等量的Ne气,则达到平衡时,B中NO2的转化率将_________(填:变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_________中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为_________。
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题:
(1)E、F气态氢化物的稳定性为____________ > ______________(用化学式表示)。
(2)E与F可形成E2F2的化合物,其电子式为_________ ____________,其晶体类型为________________。
____________,其晶体类型为________________。
(3)C、D形成的一种化合物能与D、E形成的化合物在溶液中发生氧化还原反应,其离子方程式为:
_______________________________________________________________________。
(4)A、C、E三种元素形成的一种常见化合物H,其浓溶液在加热条件下可与a g铜反应,则被还原的H的物质的量为___________________。
(5)E的一种常见氧化物为大气污染物,实验室可用足量D的最高价氧化物的水化物来吸收,则吸收生成的盐溶液中离子浓度大小关系为:
_____________________________________________________________________。
(6)b g D单质在纯净的C单质中燃烧放出Q kJ热量,则相关的热化学方程式为: _______________________________________________________。
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。
Ⅰ.染料工业排放的废水中含有大量有毒的NO2¯,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为 。
Ⅱ.某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
| 开始沉淀时的pH |
1.9 |
7.0 |
—— |
—— |
4.7 |
—— |
| 沉淀完全时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 。
(2)加入H2O2的作用是 。
(3)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是
(选填:Fe3+、Al3+、Ca2+、Mg2+)。
Ⅲ.印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤① ② ③过滤。(提供的药品:Cl2浓H2SO4 NaOH溶液 CuO Cu)
(16分)氨气是一种重要的基础化工原料,用途广泛。
(1)在微电子工业中,氨水可作刻蚀剂H2O2的清除剂,产物不污染环境。该反应的化学方程式为2NH3+ 3H2O2= +6H2O
(2)工业中常用以下反应合成氨:N2+3H2 2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) =" 0.100mol/L," c(H2) = 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。
2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) =" 0.100mol/L," c(H2) = 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。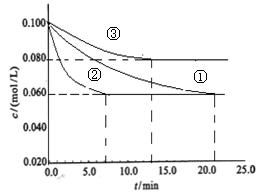
该反应平衡常数的数学表达式为;实验②平衡时H2的转化率为_____。
(3)据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:_______理由:________
③条件:_______理由:________
已知: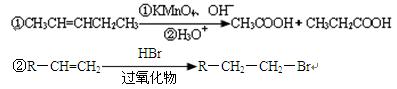
(1)下面是一有机合成反应的流程图: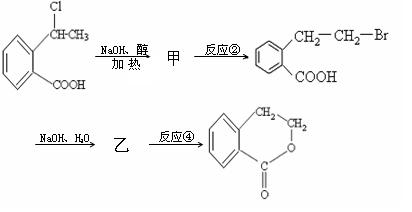
请写出甲与乙的结构简式,甲:乙:
反应②、④的反应类型:、
(2)香豆素的核心结构是芳香内酯A,A经下列步骤转变为水杨酸。
写出化合物C的结构简式______;芳香内酯A的核磁共振氢谱共有个吸收峰;D的同分异构体中,是苯的对二取代物,且水解后的一种产物能发生银镜反应,请写出其中一种的结构简式:。
(1)在反应MnO2 + 4HCl = MnCl2 + 2H2O +Cl2↑中,
①还原剂是;
②HCl中,被氧化的Cl原子与未被氧化的Cl原子个数比是 。
③若要产生112 mL氯气,则转移的电子数目是。
(2)、(3分)将2.3g钠投入水中,充分反应后,得到的溶液中Na+与水分子的个数比为1:100,则反应所需的m(H2O)="________"