氨基甲酸铵(NH2COONH4)是一种白色固体,在干燥空气中稳定,但在湿空气中则放出氨而变成碳酸氢铵、59℃时分解为氨及二氧化碳、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组用模拟制备氨基甲酸铵,反应的化学方程式如下:2 NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用图1装置制取氨气,你所选择的试剂是 。
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。 当悬浮物较多时,停止制备。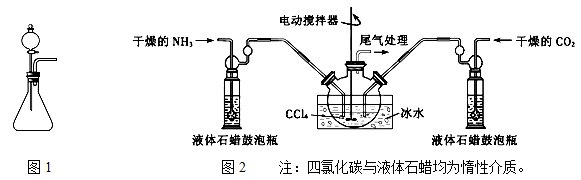
①发生器用冰水冷却的原因是___________ __________________。
液体石蜡鼓泡瓶的作用是_____________________________ _。
②从反应后的混合物中分离出产品的实验方法是_______(填写操作名称)。 为了得到干燥产品,应采取的方法是________(填写选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c.真空40℃以下烘干
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为___________。
惰性电极电解NaCl溶液或CuSO4溶液都得到三种产物A、B、C,各物质之间的转化关系如下图所示(图中参与反应和生成的水都已略去)。已知甲是短周期元素的单质,它是日常生活中常用的包装材料。
回答下列问题:
(1)若电解的是NaCl溶液:
①甲与A反应的化学方程式是 ;
②A与B反应的离子方程式是 ;
③若电解100mL0.1mol·L-1NaCl溶液,阴、阳两极各产生112mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化及气体溶于水的影响)
(2)若电解的是CuSO4溶液:
①E的化学式是;电解时阳极的电极反应式是 ;
②加热时,A的浓溶液可与B发生反应,A的浓度随时间变化的图像正确是。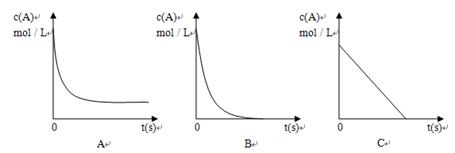
已知CH2=CH-CH=CH2(1,3-丁二烯)与氯气发生加成反应有两种方式:
CH2=CH-CH=CH2 +Cl2→ CH2ClCHCl-CH=CH2 (1,2-加成)
CH2=CH-CH=CH2 + Cl2→ CH2ClCH=CHCH2Cl (1,4-加成)
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为 ;
;
(2)A中的碳原子是否都处于同一平面?(填“是”或者“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
反应②的化学方程式为;
E2的结构简式是;⑥的反应类型是。
Ⅰ.如下图所示,将2molA气体和1molB气体充入一容积可变的密闭容器中,发生反应:2A(g)+B(g)  2C(g).反应开始时可滑动的活塞的位置如甲图所示,当反应达到平衡时,活塞位置如乙图所示。则当达到平衡时,A的转化率为;该条件下的反应的平衡常数为。
2C(g).反应开始时可滑动的活塞的位置如甲图所示,当反应达到平衡时,活塞位置如乙图所示。则当达到平衡时,A的转化率为;该条件下的反应的平衡常数为。
Ⅱ.(1)已知298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3KJ。写出该反应的热化学方程式。
(2)利用该反应可设计一个燃料电池:用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气。写出负极的电极反应式。
(3)用石墨做阳极,铁棒做阴极,电解硫酸铜溶液,则石墨棒上的电极反应式为;如果起始时盛有1000mL PH=5的硫酸铜溶液(25℃)(足量),一段时间后溶液的PH变为1,若要使溶液恢复到起始浓度(忽略溶液体积变化),可向溶液中加入(填物质名称),其质量约为。
C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质。D元素的原子的最外层电子数是次外层电子数的3倍,C、G同周期,且原子最外层电子数相差4,它们的简单离子电子层结构不同。相互间有如下转化关系:
请填空:
(1) D与I能形成 原子个数比为1:1的共价化合物,请写出其分子式:;
原子个数比为1:1的共价化合物,请写出其分子式:;
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学式:。
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%。反应①的化学方程式是,引发该反应的操作是
(4)写出A+F → J的离子方程式:。
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)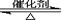 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如下图所示。根据图示回答下列问题: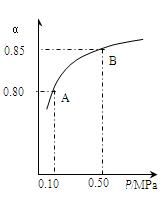
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示)。放出的热量为______kJ。
(3)新型纳米材料氧缺位铁酸盐
(MFe2Ox 3<x<4,M为Mn、Co、Zn或Ni),是由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
请写出MFe2Ox分解SO2的化学方程式(不必配平)。