A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);D原子的基态电子排布式为____________________________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC的空间构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。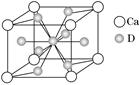
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________。
有机物H(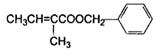 )是一种重要的香精素,有关合成路线如下:
)是一种重要的香精素,有关合成路线如下:
(1)反应④的反应类型 ;F的结构简式
(2)E中含有的官能团名称 :A的名称是
(3)E有多种同分异构体,其中一种满足以下条件:
①与E碳链结构相同:②核磁共振氢谱显示有五种氢:③能发生银镜反应。得到的有机产物酸化后能发生酯化反应生成五元环状分子。
请写出该同分异构体的结构简式:
(4)写出反应⑥的化学方程式:
(5)下列有关G的说法正确的是 。
a.能使酸性KMnO4溶液褪色,或溴的CCl4溶液褪色
b.既能发生取代反应,也能发生加成反应
c.1molG物质完全燃烧耗8.5molO2
d.能与Na2CO3反应,不能与NaOH反应
有机物D是一种合成抗高血压药的重要通用中间体,其合成路线如下:(已知A是一种芳香酸)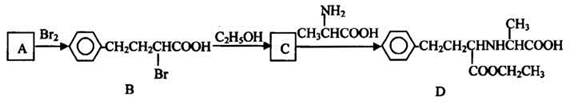
(1) A、C的结构简式分别是_______、_______,D中含有的含氧官能团名称是_______.
(2) C→D的反应类型是_______
(3)加热条件下,C在足量NaOH水溶液中反应的化学方程式是_______.
(4) E是一种相对分子质置比A小14的芳香酸。写出满足下列条件的E的所有同分异构体的结构简式:_______________
①能发生银镜反应②一定条件下可发生水解反应③分子的核磁共振氢谱中有四组峰
(5) F是B在碱溶液中水解后再酸化的产物。F在一定条件下可聚合成髙分子化合物,写出该反应的化学方程式_____________________.
X、Y、Z、W是元素周期表前四周期常见的四种元素,原子序数依次增大。X的单质既有σ键乂有π键,且X的第一电离能比其相邻元素都大,Y的电负性比X的小,其基态原子最外层的p电子是该层s电子的两倍,Z是前36号元素中原子半径最大的主族元素,W的一种核素的质量数是56,中子数是30。
(1) Y位于元素周期表第_______周期第_______族,W2+的核外电子排布式是______。
(2) X的氧化物XO2与H2O比较,熔点较高的是_______ (填化学式),Z的氢化物属于晶体,Z2O2的化学键类型是_______(填编号)
| A.离子键 | B.极性共价键 | C.非极性共价键 | D.金属键 |
(3)加热条件下,Y的单质与足量的X的最高价氧化物的水化物的浓溶液反应,生成Y的最髙价含氧酸,写出此反应的化学方程式_______.
(4)在250C,101kPa下,W的单质在氧气中燃烧后恢复至原温度和压强,平均每转移1mol电子放出QkJ的热量,则W单质燃烧的热化学方程式是_______。
化合物F的合成路线如下图所示。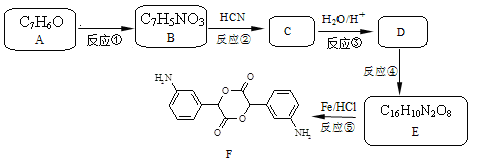

(1)写出反应类型:反应②;反应④。
(2)写出结构简式:B;E。
(3)在D转化为E的过程中可能生成了一种高分子化合物G,写D→G反应的化学方程式:。
(4)以下是由CH3CH=CHCOOH制备CH3CH=C(COOH)2的合成路线。
①写出Ⅲ的结构简式:;
②写出反应⑥的化学方程式:。
有机物A(C11H12O2)可用来调配果味香精,其合成路线如下: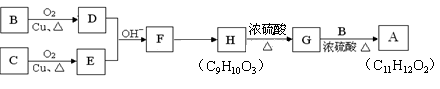
已知:①两个醛分子间能发生如下反应: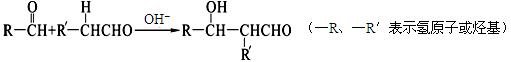
②C的分子式为C7H8O,能与钠反应,不与碱反应,也不能使Br2的CCl4溶液褪色。
(1)上述合成过程中,有机物没有涉及的反应类型有:(填写序号)。
a.酯化反应 b.加成反应 c.消去反应 d.氧化反应 e.还原反应
(2)写出结构简式。C:; A:。
(3)H生成G的化学方程式:。
(4)F的同分异构体有多种,写出既能发生银镜反应又能发生水解反应,且苯环上只有一个取代基的所
有同分异构体的结构简式。