固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法不正确的是( )
| A.1 mol NH5中含有5 NA个N—H键(NA表示阿伏加德罗常数) |
| B.NH5中既有共价键又有离子键 |
C.NH5的电子式为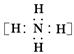 + +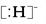 |
D.它与水反应的离子方程式为NH4++H-+H2O NH3·H2O+H2↑ NH3·H2O+H2↑ |
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是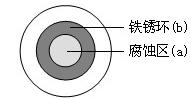
| A.液滴中的Cl―由a区向b区迁移 |
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- 4OH- 4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e- Cu2+ Cu2+ |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是()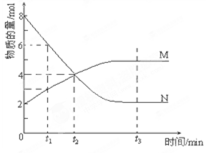
A.反应的化学方程式为:2M N N |
B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 | D.t1时,N的浓度是M浓度的2倍 |
从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限。之所以有先后。主要取决于()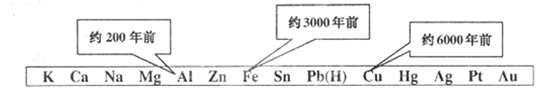
| A.金属的导电性强弱 | B.金属在地壳中的含量多少 |
| C.金属的化合价高低 | D.金属的活动性强弱 |
据报道,科学家已成功合成了少量 ,
, 的结构如图所示:有关
的结构如图所示:有关 的说法不正确的是()
的说法不正确的是()
A. 和 和 互为同素异形体 互为同素异形体 |
B. 形成的晶体为原子晶体 形成的晶体为原子晶体 |
C.相同质量的 和 和 所含原子个数比为1:1 所含原子个数比为1:1 |
D. 的摩尔质量是56g·mol-1 的摩尔质量是56g·mol-1 |
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应2A(g)+B(g)  2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
2C(g),若2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
①用物质A表示反应的平均速率为0.3 mol/(L·s)
②用物质B表示反应的平均速率为0.6 mol/(L·s)
③2s时物质A的转化率为60%④2 s时物质B的浓度为0.7 mol/L
其中正确的是( )
| A.①③ | B.①④ | C.②③ | D.③④ |