25 ℃时,电离平衡常数:
| 弱酸的化学式 |
CH3COOH |
HClO |
H2CO3 |
| 电离平衡常数(25 ℃) |
1.8×10-5 |
3.0× |
K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质:
a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;
pH由大到小的顺序是 (填编号)。
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是 ;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是 ,
稀释后,HX溶液中水电离出来的c(H+) (填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是 ; 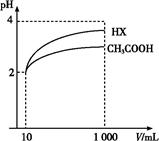
(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)= (填准确数值)。
用质量分数为98%,密度为1.84g·cm-3的浓硫酸配制l mol/L稀硫酸100mL,其操作有以下各步:
①用量筒量取mL浓硫酸
②洗涤烧杯和玻璃棒2-3次,将洗涤液转入容量瓶中
③将稀释、冷却后的硫酸转入100 mL容量瓶中
④将浓硫酸倒入盛有水的烧杯中稀释、冷却
⑤加水至液面接近刻度线1~2cm处,定容,摇匀
完成下列填空:
(1)第①步操作中应用量筒量取mL浓硫酸;应选择mL量筒(填5、10或50)。
(2)本实验用到的基本仪器已有烧杯、量筒、玻璃棒,还缺少的仪器是。
(3)正确的操作顺序是(用序号填写)。
(4)下列操作会使实际浓度偏高,偏低还是不变,请填写:
1).摇匀后,液面低于刻度线,没有再加水;
2).移液过程中,不小心溅出少量溶液;
3).定容时,如果俯视刻度线,配制的硫酸浓度将
CO、O2、CO2混合气体9mL电火花引爆后,恢复到原来状态时,气体体积减少1mL,通过NaOH溶液后,体积又减少5mL,则混合气体中CO、O2、CO2体积比可能为 _____ 。
现有m g某气体,它由四原子分子构成,它的摩尔质量为M g·mol-1。则:
(1)该气体的物质的量为________。
(2)该气体中所含的原子总数为________个。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为________。
对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、加热分解等。下列各组混和物的分离或提纯应采用什么方法?
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)用CCl4提取溴水中的溴,可采用的方法。
(3)粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。对粗盐中的这些杂质可采用和的方法除去。
(4)除去氧化钙中的碳酸钙可用的方法。
现有①铁片 ②NaCl溶液③氨水④醋酸⑤酒精⑥盐酸 ⑦H2SO4
⑧KOH固体 ⑨蔗糖 ⑩KAl(SO4)2·12H2O,其中能导电的是,属于电解质的是_______,属于非电解质的是,属于酸的是,属于碱的是。(填序号)