(9分)将一支盛有a mL NO和b mL NO2气体的试管倒立于水槽中,然后通入a mL O2,问:
(1)若a=b,则充分反应后试管内气体体积为__________mL。
(2)若a<b,则充分反应后试管内气体体积为__________mL。
(3)若a>b,则充分反应后试管内气体体积为__________mL。
下图所示物质中(部分产物和反应条件未标出),只有A是单质,常温下B和C呈气态,且B是导致酸雨的大气污染物,W是淡黄色固体。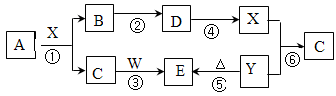
据此回答下列问题:
(1)物质W的名称为,由B生成D的化学方程式为。
(2)请写出X和 Y反应的离子方程式:。
(3)上图反应中不属于氧化还原反应的有(填写序号)。
(4)写出A和X反应的化学方程式;若生成的B在标准状况下的体积为22.4L,则反应中转移电子数目为。
(5)请写出C和W反应的化学方程式:。在这个反应中生成1mol气体转移电子的物质的量为。
1 (6分)有以下几种物质
①乙醇②MgCl2晶体③蔗糖④铜⑤食盐水⑥BaSO4
请填空回答(填序号)。
(1)以上物质中能导电的是;
(2)以上物质中属于电解质的是;
(3)以上物质中属于非电解质的是。
2.(4分)现有CO和CO2的混合气体18g,充分与氧气反应后测得所得到的CO2的总体积为11.2L(标准状况)。试计算
(1)原混合气体中CO2的体积(标准状况)是,
(2)原混合气体在标准状况下的密度是g/L (结果保留一位小数)
(10分)某学生利用以下装置探究氯气与氨之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置。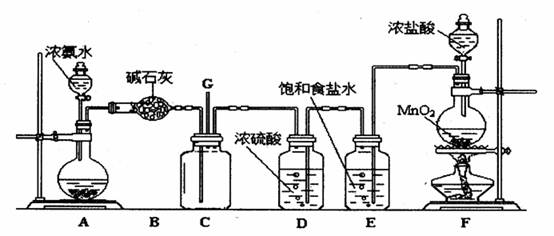
请回答下列问题:
(1)装置F中发生反应的化学方程式为.
(2)装置B中仪器的名称是;装置E的作用是.
(3)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。
写出反应的化学方程式.
(4)装置C内当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数
常数为mol-1 (用含a、b的代数式表示)。
(5)将用F、E、D装置制得的氯气通人含74gCa(OH)2的石灰乳中,最多可制得漂白粉g.
(8分)已知:CH3CH2OH+NaBr+H2SO4(浓)  CH3CH2Br+NaHSO4 +H2O。
CH3CH2Br+NaHSO4 +H2O。
实验室制备溴乙烷(沸点为38.4℃)的装置和步骤如下:
①按右图所示连接仪器,检查装置的气密性,然后向U形管和大烧杯里加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小火加热,使其充分反应。
试回答下列问题:
(1)反应时若温度过高可看到有红棕色气体产生,该气体的化学式为
。
(2)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是__________。
(3)反应结束后,U形管中粗制的溴乙烷呈棕黄色。将U形管中的混合物倒入分液漏斗中,静置,待液体分层后,分液,取(填“上层”或“下层”)液体。为了除去其中的杂质,可选择下列试剂中的(填序号)。
| A.Na2SO3溶液 | B.H2O | C.NaOH溶液 | D.CCl4 |
(4)要进一步制得纯净的C2H5Br,可再用水洗,然后加入无水CaCl2干燥,再进行(填操作名称)。
(4)下列几项实验步骤,可用于检验溴乙烷中的溴元素,其正确的操作顺序是:取少量溴乙烷,然后(填序号)。
①加热②加入AgNO3溶液③加入稀HNO3酸化④加入NaOH溶液⑤冷却
相对分子质量为120的芳香烃X在光照条件下与Cl2反应只能得到2种一氯代物A和B,且这两种一氯代物发生消去反应只能得到一种有机物C。该有机物X经过下图的一系列反应,最终合成了含有三个六元环的有机物H和聚合物J。
【已知:光照条件下芳香烃与氯气发生取代反应,氯原子只取代烷基上的氢原子,例: 】
】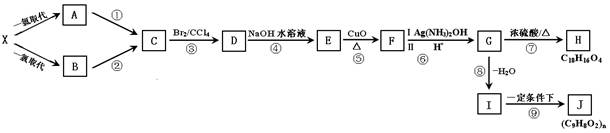
(1)X的结构简式:;
(2)①~⑨反应中属于取代反应的有:。(填序号)
(3)反应①的反应条件是:;反应⑧的反应条件是:。
(4)反应⑤的化学方程式;。
(5)反应⑦的化学方程式:。
(6)属于酯类且苯环上只有一个取代基的F的同分异构体的数目有个;
写出其中一个同分异构体:。