已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)写出A的电子式___________。
(2)B、D分子中的官能团名称分别___________、___________。
(3)写出下列反应的反应类型:①___________,②___________,④___________。
(4)写出下列反应的化学方程式:
① 。
② 。
④ 。
(3分)有Mg、Al、Fe的混合粉末4.4g与适量稀H2SO4恰好完全反应。将反应后的溶液蒸干,得到不含结晶水的固体14.0g,则反应过程中生成气体体积(标准状况)为______L。
(7分) 某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 ml 0.5 mol/L的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式。
(2)实验②中化学反应转移电子的物质的量是。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是。
(10分)下图中A~J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质。已知A~E和F~J中分别含有同一种元素。反应E→A+O2的条件未标出。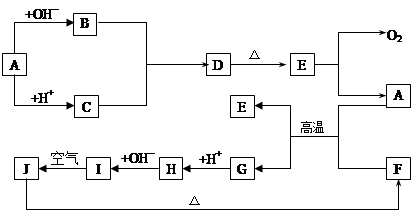
请填写下列空白:
(1)化合物H中的阳离子是;D的化学式为。
(2)A生成B反应的离子方程式是。
(3)A和F的混合物发生反应的化学方程式是。
(4)写出B与C生成D的离子方程式。
(5)I→J反应的化学方程式是。
(8分) 某无色透明的溶液可能含有K+、Cu2+、Ca2+、Br—、SO42—、CO32—、Cl—中的几种,进行如下实验:
(1)滴加氯化钡溶液,有白色沉淀产生。将沉淀滤出,并将滤液分为两份,产生的沉淀可部分溶于稀硝酸。
(2)取一份滤液,向其中加入氯水并加入四氯化碳,振荡后静置,四氯化碳层呈橙色。
(3)向另一份滤液中加入硝酸银溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
(4)取原溶液做焰色实验,透过蓝色钴玻璃观察到紫色。
试判断:该溶液中一定有离子,肯定没有离子,可能有离子。要进一步确定可能存在的离子,还需要做的实验是
氮化硅(Si3N4)是一种重要的结构陶瓷材料,属于新型功能性硅酸盐产品,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300 ℃时反应获得。
(1)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式______________________________________________。
(2)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅及氯化氢,反应的化学方程式为__________
(3)沸石是一种含结晶水的,具有多孔结构的铝硅酸盐,化学式为Na2[Al2Si3O10(H2O)2],若以氧化物形式可表示为。
(4)盛装氢氧化钠溶液的试剂瓶不能用玻璃塞的原因是:(用离子方程式表示).