氮元素及其化合物在国防科学技术生产中有重要应用。
(1)写出实验室制NH3的化学反应方程式
(2)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,氢气的来源是水和碳氢化合物,写出以天然气为原料制取氢气的化学反应方程式 。
(3)在合成氨的原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
(4)在容积为2L容器中发生反应CO(g)+H2O(g) CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ
CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ
若在t0时刻将容器的体积扩大至4L,请在答题卡图中绘出c(CO)与反应时间t变化曲线Ⅱ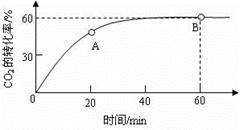
(5)工业上尿素CO(NH2)2由CO2和NH3在一定条件下合成,其化学反应方程式为
(6)合成尿素时,当氨碳比 =4,CO2的转化率随时间的变化关系如右图所示.
=4,CO2的转化率随时间的变化关系如右图所示.
①A点的逆反应速率v逆(CO2) B点的正反应速率为v正(CO2)(填“>”、“<”或“=”)
②NH3的平衡转化率为 。
(1)向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH7,(填>、=、<,下同)离子反应总方程式为。
(2)向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子刚好沉淀完全时,溶液的 pH7,离子反应总方程式为 。
。
化合物SOCl2是一种液态化合物,沸点为77℃。在盛10ml水的锥形瓶中小心滴加8-10滴SOCl2可观察到剧烈反应,液面上形成白雾,并有刺激性气味的气体放出,该气体可使湿润的品红试纸褪色。在反应后的溶液中滴加AgNO3溶液,可生成一种不溶于稀HNO3的白色沉淀。
(1)试据上述实验事实,写出SOCl2与水反应的化学方程式。
(2)将ZnCl2溶液蒸发至干,得不到无水ZnCl2,工业上常用ZnCl2•2H2O与SOCl2共热制取ZnCl2。试结合离子方程式解释原因:。
(3)科学家经常利用 水解原理制备纳米材料,请写出用TiCl4制备TiO2·xH2O的化学方程式:。
水解原理制备纳米材料,请写出用TiCl4制备TiO2·xH2O的化学方程式:。
 在一定体积的密闭容器中,进行如下化学反
在一定体积的密闭容器中,进行如下化学反 应:
应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。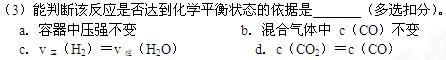
恒温恒压下,在一个可变容积的容器中发生如下反应: A(g) + B(g)  C(g)
C(g)
(1)若开始时放入1molA和1molB,达到平衡后,生成amolC,这时A的物质的
量为mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为mol
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,C的物质的量是3amol,x=mol.
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量是 mol.
mol.
等物质的量A、B、C、D四种物质混合,发生如下反应: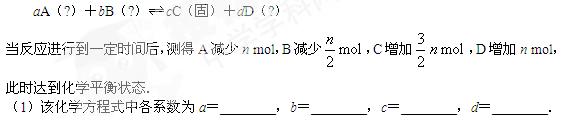
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,则该反应中各物质的聚集状态是:A_________,B_________,D_________.
(3)若只升高温度,反应一段时间后,测知四种物质的量又达到相等,则该反应是
________反应(填“放热”或“吸热”)