TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+2CCl4(g)=TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下

有关性质如下表
| 物质 |
熔点/℃ |
沸点/℃ |
其它 |
| CCl4 |
-23 |
76 |
与 TiCl4互溶 |
| TiCl4 |
-25 |
136 |
遇潮湿空气产生白雾 |
仪器A的名称是____ ,装置E中的试剂是 。反应开始前必须进行的操作是____ ;反应结束后的操作包括:①停止通氮气②熄灭酒精灯③冷却至室温。正确的顺序为____ (填序号)。欲分离D中的液态混合物,所采用操作的名称是 。
(2)工业上由钛铁矿(FeTO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶:FeTiO3(s)+2H2SO4(aq) FeSO4(aq)+TiOSO4(aq)+2H2O(1)
水解;TiOSO4(aq)+2H2O(1) H2T1O3(s)+H2SO4(aq)
简要工艺流程如下:

①试剂A为 。钛液I需冷却至70℃左右,若温度过高会导致产率降低,原因是 。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是____ ,写出其中发生氧化还原反应的离子方程式____ 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是____ (填化学式)。
已知浓硫酸与木炭粉在加热条件下会发生剧烈反应:C+2H2SO4(浓) 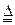 CO2↑+2SO2↑+2H2O↑。试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。
CO2↑+2SO2↑+2H2O↑。试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。
(1)这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号)______→______→______→______。
(2)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是__________________,B瓶溶液的作用是__________________,C瓶溶液的作用是____________。
(3)装置②中所加的固体药品是______,可验证的产物是______,确定装置②在整套装置中位置的理由是____________。
(4)装置③中所盛溶液是______,可验证的产物是______。
实验室制氨气通常有三种方法:①用固体氢氧化钙和氯化铵反应(装置同课本);②称取7.9 g碳酸氢铵固体放入试管内,再加入8 g氢氧化钠固体,常温下即能产生氨气(装置如下图中甲);③在锥形瓶中注入50 mL浓氨水,再加入10 g氢氧化钠固体(装置如下图中乙)。选取三个250 mL的干燥的烧瓶及瓶塞,用于收集三种制法的氨气。请完成下列问题: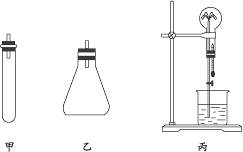
(1)写出用②法制取氨气的化学方程式:__________________________________________。
(2)说明用③法制取氨气的原理:________________________________________________。
(3)检验氨气已收集满的方法:__________________________________________________。
(4)用集满氨气的烧瓶做喷泉实验,装置如图中丙(烧杯内盛酚酞溶液),其现象是_____
_______________________________________________________________________________。
为了测定硫酸铵和氯化铵混合物中氯化铵的质量分数,甲、乙两位同学按下列实验步骤进行实验:称量样品→溶解→加过量试剂A→过滤出现沉淀B→洗涤沉淀→烘干称量→处理实验数据并得出结果。
(1)实验时,甲同学选用硝酸银溶液作试剂A,乙同学选用氯化钡溶液作试剂A,其中同学所选的试剂A不合理,理由是________________。
(2)以下都是在试剂A选择正确时进行的实验:
①为进行称量、溶解、反应、过滤、洗涤沉淀的各项操作,准备了以下仪器:托盘天平与砝码,烧杯、过滤器、铁架台及附件,胶头滴管、量筒,其中还缺少一件必备的仪器是_____________。
②若过滤所得沉淀未经洗涤烘干称量,测得结果将________(填“偏高”或“偏低”)。
③若实验测得混合物的质量为W g,沉淀物的质量为m g,实验测定的氯化铵质量分数计算式=_____________。
Ⅰ.合成氨工业对化学和国防工业具有重要意义。写出氨的两种重要用途_________________________________。
Ⅱ.实验室制备氨气,下列方法中适宜选用的是__________________。
①固态氯化铵加热分解
②固体氢氧化钠中滴加浓氨水
③氯化铵溶液与氢氧化钠溶液共热
④固态氯化铵与氧化钙混合加热
Ⅲ.为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图119中夹持装置均已略去)。
图1-9
[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气产生。在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
完成下列问题:
(1)检验氢气纯度的目的是___________________________。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是__________________,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是___________________________,C瓶内气体的成分是_________。
(3)在步骤③中,先加热铁触媒的原因是____________________________________。反应管E中发生反应的化学方程式是___________________________。
制取氨气并完成喷泉实验(图中夹持装置均已略去)。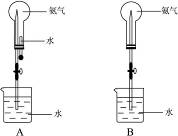
(1)写出实验室制取氨气的化学方程式:_________________________________________。
(2)收集氨气应使用___________法,要得到干燥的氨气可选用_____________作干燥剂。
(3)用图A装置进行喷泉实验,上部烧瓶已装满氨气,引发水上喷的操作是___________。该实验的原理是___________________。
(4)如果只提供如图B的装置,请说明引发喷泉的方法:___________________________。