石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如下图所示(部分仪器已忽略)。在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水。

实验现象:
试管①中加热一段时间后,可以看到试管内液体沸腾;
试管②中有少量液体凝结,闻到汽油的气味,往液体中滴加几滴高锰酸钾酸性溶液颜色褪去.根据实验现象回答下列问题:
(1)装置A的作用是__________
(2)试管①中发生的主要反应有:
C17H36 C8H18+C9H18 C8H18
C8H18+C9H18 C8H18 C4H10+C4H8
C4H10+C4H8
丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为__________和__________,这两种有机物混合后在一定条件下可聚合成高分子化合物,其反应类型属于__________反应.其可能结构为__________(答案可能不止一个,下同)

(3)写出试管③中反应的一个化学方程式__________,该反应的类型为__________反应.
(4)试管②中的少量液体的组成是__________(填序号) ①甲烷 ②乙烯 ③液态烷烃 ④液态烯烃.
松花蛋于明朝初年问世。其腌制配方有多种,但主要配料为生石灰(CaO)、纯碱(Na2CO3)和食盐(NaCl)。将一定比例的配料用水和粘土调制成糊状,敷于蛋上,密封保存,数日后即可食用。
(1)腌制皮蛋的配料用水调制时,主要反应的化学方程式为(不考虑粘土中物质可能参与的反应)
。
(2)松花蛋外的糊状物经水溶解、过滤,滤液中肯定大量含有的溶质为和,可能含有的物质为Ca(OH)2或Na2CO3。
(3)某同学设计如下表所示的实验方案,探究(2)所得滤液中可能含有的物质是否存在,请你帮他完善实验方案。
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量滤液,滴加适量K2CO3溶液 |
滤液中含 |
|
| 滤液中无 |
||
| ②另取少量滤液,滴加 |
滤液中含 |
|
| 滤液中无 |
问题讨论:在什么情况下不必做实验②就可以得出滤液中有无Na2CO3的结论?
海带中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:(已知:Cl2 + 2KI =" 2KCl" + I2)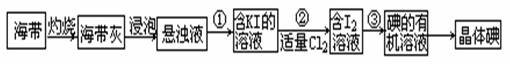
(1)提取碘的流程中:步骤①需要的主要仪器是,步骤③需要的主要仪器是(填序号)
(2)写出步骤②中涉及的有关离子反应方程式。
(3)提取碘的过程中,可供选择的有机试剂有。
| A.四氯化碳 | B.醋酸 | C.酒精 | D.苯 |
有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
① 将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
② 向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③ 取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④ 另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是,一定不含有的物质是,可能含有的物质是。(写化学式)
(2)写出各步变化的离子方程式。
① ;
② ;
③;
④
。
资料显示:“氨气可在纯氧中安静燃烧生成稳定的单质和化合物……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。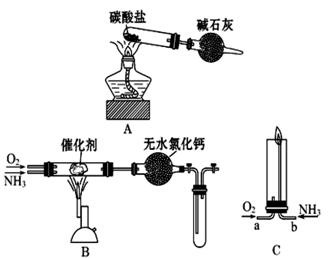
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式
是__ _ __;碱石灰的作用是____ ___。
(2)将产生的氨气与过量的氧气通到装置
B(催化剂为铂石棉)中,用酒精喷灯加热。
请写出氨催化氧化的化学方程式是 ;
试管内气体变为红棕色。
(3)将过量的氧气与A产生的氨气分别从a、b
两管进气口通入到装置C中,并在b管上端点燃氨气:①两气体通入的先后顺序是______ ___;
②氨气燃烧的化学方程式是___。
下图所示是分离混合物时常用的仪器,回答下列问题: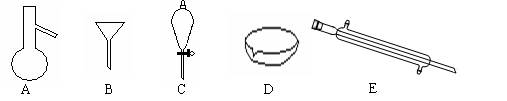
(1)写出仪器C、E的名称、
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①粗盐和泥沙:②花生油和水:
(3)下列关于仪器的使用说法正确的是
A.A仪器可以用酒精灯直接加热
B.B仪器可以用于向酒精灯中添加酒精
C.C仪器在放出液体时应打开上边的瓶塞
D.在实验室应用D仪器进行实验时要不断用玻璃棒搅拌
E.E仪器中水的流向是上进下出
(4)若向C装置中加入碘水和足量CCl4,充分振荡后静置,会观察到什么现象?