下列图示与对应叙述相符的是
| A.图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化 |
B.图②表示压强对可逆反应A(g)+2B(g)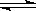 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
C.图③中曲线表示反应3A(g) + B(g)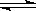 2C(g)△H<0,正、逆反应的平衡常数K随温度的变化 2C(g)△H<0,正、逆反应的平衡常数K随温度的变化 |
| D.据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右 |
对于可逆反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,下列研究目的和示意图相符的是
2SO3(g) ΔH<0,下列研究目的和示意图相符的是
| A |
B |
C |
D |
|
| 研究目的 |
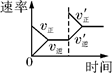
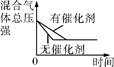
压强对反应的影响(p2>p1) |
温度对反应的影响 |
平衡体系增加O2的浓度对反应的影响 |
体积恒定的密闭容器中催化剂对反应的影响 |
| 示 意 图 |
 |
 |
 |
 |
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下图所示,下列说法正确的是
| A.HA为强酸 |
| B.该混合液pH=7 |
| C.图中X表示HA,Y表示OH—,Z表示H+ |
| D.该混合溶液中:c(A—)+ c(Y)=c(Na+) |
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=-lgc(M),p(CO32-)=-lgc(CO32-)。下列说法正确的是
| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32-) |
| C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)=c(CO32-) |
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是
| A.溶质的电离方程式为NaHCO3=Na++ H++ CO32- |
| B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 |
| C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D.温度升高,c(HCO3-)增大 |
标准状况下,气态分子断开1mol化学键的焓变称为键焓。已知H—H,H—O和O=O键的键焓△H分别为436kJ/mol,463kJ/mol,495kJ/mol,下列热化学方程式正确的是
| A.H2O(g)=H2(g)+1/2O2(g) △H =-485kJ/mol |
| B.H2O(g)=H2(g)+1/2O2(g) △H =+485kJ/mol |
| C.2H2(g)+O2(g)=2H2O(g) △H =+485kJ/mol |
| D.2H2(g)+O2(g)=2H2O(g) △H =-485kJ/mol |