硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等。
(1)新制的绿矾(FeSO4·7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式: 。
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;
SO3熔点是16.8℃,沸点是44.8℃。
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”。
上述装置Ⅲ和Ⅳ用来检验气体产物。试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是 。
②装置Ⅲ中的试剂可以是 (选填序号,下同),现象是 ,则证明气体产物中含有SO2; 装置Ⅳ中的试剂可以是 。
| A.2 mol/LNa2CO3溶液 |
| B.品红溶液 |
| C.0.5 mol/LBaCl2溶液 |
| D.0.5 mol/LBa(NO3)2 |
E. 0.01 mol/LKMnO4溶液
F. 淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为 。
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如
下实验:
| 操作步骤 |
预期实验现象 |
预期实验结论 |
| 向其中一份溶液中加入 。 |
|
固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液。 |
产生蓝色沉淀 |
|
⑤若用22.8 g FeSO4固体做实验,完全分解后,得到11.2 g固体,其中Fe2O3的质量分数=
(精确到0.1%)
常见的化肥有氨水、NH4Cl、NH4HCO3、(NH4)2SO4、K2CO3、尿素[CO(NH2)2]等。为确定某种化肥的组成,进行下列实验:
①取少量化肥与烧碱共热,放出可使湿润的红色石蕊试纸变蓝的气体。此气体为,证明化肥中含离子(填写离子符号)。
②向上述反应后的溶液中注入过量盐酸,生成的无色无味气体可使澄清石灰水变浑浊。此气体为,证明化肥中含有或离子(填写离子符号)。
③另取少量化肥溶于水,加入CaCl2溶液无明显反应现象。由上可知该化肥的化学式为。
(8分)实验室用下列反应制取CO2和CO:H2C2O4 CO2 + CO + H2O,然后用下图所示装置将CO2和CO进行分离和干燥,已知分液漏斗中为稀硫酸,甲瓶中为NaOH溶液。试回答下列各题:
CO2 + CO + H2O,然后用下图所示装置将CO2和CO进行分离和干燥,已知分液漏斗中为稀硫酸,甲瓶中为NaOH溶液。试回答下列各题: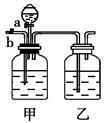
(1)乙瓶中装的是;
(2)关闭分液漏斗活塞a,打开b,通入混合气体,在右端收集到的气体是,甲中反应的离子方程式为;
(3)通入气体结束后,得到另一种气体的方法是:关闭活塞(填写a或b,下空同)打开,在右端收集气体,此时甲中反应的离子方程式为。
(本题共10分)
中和滴定不仅可以测定酸或碱的物质的量浓度,还可以测定某些混合物的含量。
烧碱是重要的化工原料,工业烧碱中可能含有少量NaCl。为测定工业烧碱样品中NaOH的质量分数,进行如下实验:
(1)称取1. 000g样品,配制成250mL待测液。
(2)量取20.00mL待测液,用0.1000mol/L标准盐酸溶液滴定。
46.将1.000g样品配成250mL待测液,所用的玻璃仪器有:烧杯、玻璃棒、胶头滴管;
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验: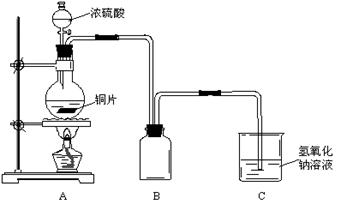
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2)实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:________(填写字母编号)。
A.铁粉 B.氯化钡溶液C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,某位同学进行了如下设计:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中可行的是__________(填写字母编号)。其中计算结果余酸物质的量浓度比实际偏高的是_______________(填写字母编号)
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀(已知:硝酸具有强氧化性)
若A项不可行,请写出改进的方法:___________________(若A项可行则该空写“不用改进”)
Ⅰ已知:Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
| 实验序号 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
| V/mL |
c/(mol/L) |
V/mL |
c/(mol/L) |
V/mL |
||
| ① |
20 |
10.0 |
0.10 |
10.0 |
0.50 |
0 |
| ② |
40 |
V1 |
0.10 |
V2 |
0.50 |
V3 |
| ③ |
20 |
V4 |
0.10 |
4.0 |
0.50 |
V5 |
(1)该实验①、②可探究对反应速率的影响,因此V1=,V2=;V3=;
(2)实验①、③可探究对反应速率的影响,因此V4=,V5=;
(3)下列有关该的相关叙述正确的是
A.实验前,应先在一张白纸上用黑墨水笔在白纸上画粗浅一致的“+”字,衬在锥形瓶底部,实验中记录反应开始到产生的浑浊将锥形瓶底部的“+”字刚好完全遮盖所需的时间
B.该实验所需的计量仪器有量筒、温度计
C.实验时,应先将量取的Na2S2O3 和H2SO4溶液混合,然后置于相应温度的热水浴中反应,记录每组反应所需时间
D.每组实验至少需要两支量筒
(4)实验过程中为什么不用测量一定时间内放出SO2气体的量来表示该反应的化学反应速率的大小?。
Ⅱ利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可以定量测定市售硫代硫酸钠(Mr=158)的纯度,现在称取Wg硫代硫酸钠固体样品,配成250mL的溶液,取25.00mL置于锥形瓶中,加入指示剂,用含有I2为amol/L的碘水滴定,消耗碘水bmL,则:
(1)验过程中滴定管应该选择的是(酸式或碱式)滴定管,滴定前可以选择做指示剂,滴定终点的现象为
(2)对于该滴定实验的有关操作或误差分析正确的是。
A.滴定前,应对滴定管、锥形瓶进行润洗操作
B.滴定过程中,标准液滴到锥形瓶外,会使所测结果偏大
C.滴定管在滴定开始时尖嘴有气泡,滴定完成后气泡消失,则所测得的纯度将会偏小
D.滴定前仰视读数而滴定结束时俯视读数,则所测得的纯度将会偏小
(3)样品中硫代硫酸钠纯度的表达式为。